题目
CO2分压力为50kPa的混合气体,分别与CO2浓度为=1.662times (10)^5times kPa.05kmol/(m)^3.01kmo1/(m)^3的水溶液和CO2浓度为=1.662times (10)^5times kPa.05kmol/(m)^3.01kmo1/(m)^3的水溶液接触。物系温度均为25℃,气液相平衡关系=1.662times (10)^5times kPa.05kmol/(m)^3.01kmo1/(m)^3。试求上述两种情况下两相的推动力(分别以气相分压力差和液相浓度差表示),并说明CO2在两种情况下属于吸收还是解吸。
CO2分压力为50kPa的混合气体,分别与CO2浓度为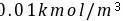 的水溶液和CO2浓度为
的水溶液和CO2浓度为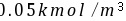 的水溶液接触。物系温度均为25℃,气液相平衡关系
的水溶液接触。物系温度均为25℃,气液相平衡关系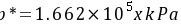 。试求上述两种情况下两相的推动力(分别以气相分压力差和液相浓度差表示),并说明CO2在两种情况下属于吸收还是解吸。
。试求上述两种情况下两相的推动力(分别以气相分压力差和液相浓度差表示),并说明CO2在两种情况下属于吸收还是解吸。
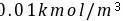 的水溶液和CO2浓度为
的水溶液和CO2浓度为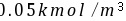 的水溶液接触。物系温度均为25℃,气液相平衡关系
的水溶液接触。物系温度均为25℃,气液相平衡关系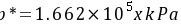 。试求上述两种情况下两相的推动力(分别以气相分压力差和液相浓度差表示),并说明CO2在两种情况下属于吸收还是解吸。
。试求上述两种情况下两相的推动力(分别以气相分压力差和液相浓度差表示),并说明CO2在两种情况下属于吸收还是解吸。题目解答
答案
解 温度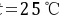 ,水的密度为
,水的密度为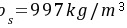
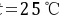 ,水的密度为
,水的密度为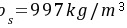
混合气中CO2的分压为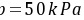
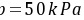
水溶液的总浓度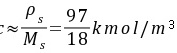 水溶液
水溶液
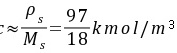 水溶液
水溶液(1) 以气相分压差表示的吸收推动力
①液相中CO2的浓度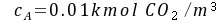 水溶液
水溶液
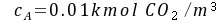 水溶液
水溶液液相中CO2的摩尔分数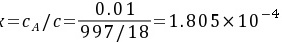
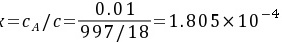
与液相平衡的气相平衡分压为
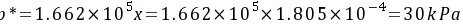
气相分压差表示的推动力 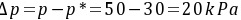 (吸收)
(吸收)
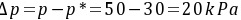 (吸收)
(吸收)② 液相中CO2的浓度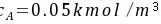 水溶液
水溶液
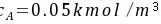 水溶液
水溶液液相中CO2的摩尔分数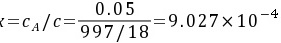
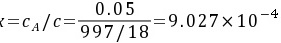
与液相平衡的气相平衡分压为
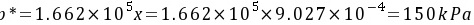
气相分压差表示的推动力 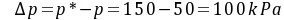 (解吸)
(解吸)
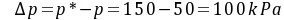 (解吸)
(解吸)(2) 以液相浓度差表示的吸收推动力
与气相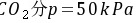 平衡的液相组成为
平衡的液相组成为
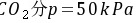 平衡的液相组成为
平衡的液相组成为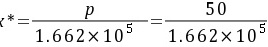
平衡的液相浓度
①液相中CO2的浓度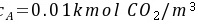 水溶液
水溶液
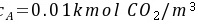 水溶液
水溶液液相浓度差表示的推动力为
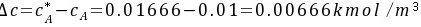 (吸收)
(吸收)②液相中CO2的浓度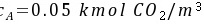 水溶液
水溶液
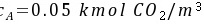 水溶液
水溶液液相浓度差表示的推动力为
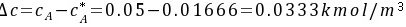 (解吸)
(解吸)解析
步骤 1:计算液相中CO2的摩尔分数
对于两种情况,分别计算液相中CO2的摩尔分数。摩尔分数的计算公式为:${x}_{A}=\dfrac{{C}_{A}}{c}$,其中${C}_{A}$为液相中CO2的浓度,$c$为水溶液的总浓度。
步骤 2:计算与液相平衡的气相平衡分压
利用气液相平衡关系$=1.662\times {10}^{5}\times kPa$,计算与液相平衡的气相平衡分压${p}_{A}^{*}$。
步骤 3:计算气相分压差表示的推动力
气相分压差表示的推动力${S}_{p}={p}_{A}-{p}_{A}^{*}$,其中${p}_{A}$为混合气中CO2的分压。
步骤 4:计算与气相CO2分压平衡的液相浓度
利用气液相平衡关系$=1.662\times {10}^{5}\times kPa$,计算与气相CO2分压平衡的液相浓度${C}_{A}^{*}$。
步骤 5:计算液相浓度差表示的推动力
液相浓度差表示的推动力${S}_{C}={C}_{A}-{C}_{A}^{*}$。
步骤 6:判断CO2在两种情况下的吸收或解吸
根据气相分压差和液相浓度差的正负,判断CO2在两种情况下的吸收或解吸。
对于两种情况,分别计算液相中CO2的摩尔分数。摩尔分数的计算公式为:${x}_{A}=\dfrac{{C}_{A}}{c}$,其中${C}_{A}$为液相中CO2的浓度,$c$为水溶液的总浓度。
步骤 2:计算与液相平衡的气相平衡分压
利用气液相平衡关系$=1.662\times {10}^{5}\times kPa$,计算与液相平衡的气相平衡分压${p}_{A}^{*}$。
步骤 3:计算气相分压差表示的推动力
气相分压差表示的推动力${S}_{p}={p}_{A}-{p}_{A}^{*}$,其中${p}_{A}$为混合气中CO2的分压。
步骤 4:计算与气相CO2分压平衡的液相浓度
利用气液相平衡关系$=1.662\times {10}^{5}\times kPa$,计算与气相CO2分压平衡的液相浓度${C}_{A}^{*}$。
步骤 5:计算液相浓度差表示的推动力
液相浓度差表示的推动力${S}_{C}={C}_{A}-{C}_{A}^{*}$。
步骤 6:判断CO2在两种情况下的吸收或解吸
根据气相分压差和液相浓度差的正负,判断CO2在两种情况下的吸收或解吸。