题目
计算25℃时下列电池的电动势(需要的数据自己查表)。-|||-(1) _(1)(H)_(2)(101325Pa)|HCl(0.1mol/kg)|(O)_(2)(101 325Pa), Pt-|||-(2) |Sn(Cl)_(2)(0.001mol/kg) (8),Sn(Cl)_(1)(0,01mol/(kg)||Fe(Cl)_(3)(0.01mol/kg), FeCl(0.001-|||-mol/kg)|Pt-|||-(3) _(Al/AgN{O)_(3)(0.1mol/kg)}||AgN(O)_(3)(1mol/kg)/A Ag

题目解答
答案
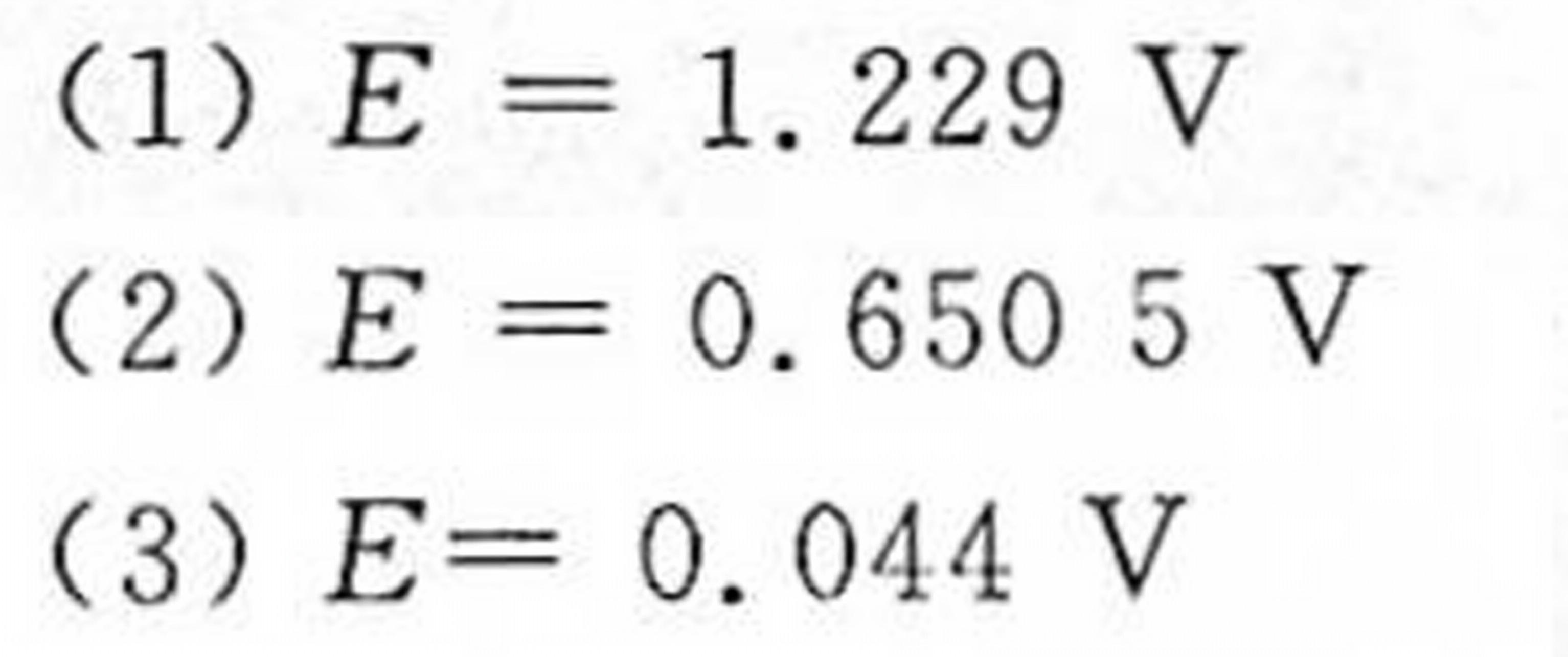
解析
步骤 1:确定电池类型和电极反应
(1) 电池类型:氢氧燃料电池
电极反应:负极:$2{H}_{2} + 4{OH}^{-} \rightarrow 4{H}_{2}O + 4{e}^{-}$
正极:${O}_{2} + 2{H}_{2}O + 4{e}^{-} \rightarrow 4{OH}^{-}$
步骤 2:计算电动势
电动势 $E$ 可以通过 Nernst 方程计算:
$E = E^{\circ} - \frac{RT}{nF} \ln Q$
其中,$E^{\circ}$ 是标准电动势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
步骤 3:计算电动势
(1) 对于氢氧燃料电池,标准电动势 $E^{\circ} = 1.229 V$,$n = 4$,$T = 298 K$,$R = 8.314 J/(mol\cdot K)$,$F = 96485 C/mol$。
反应商 $Q = \frac{[H_{2}O]^4}{[H_{2}]^2[O_{2}]}$,由于 $H_{2}$ 和 $O_{2}$ 的分压均为 $101325 Pa$,$HCl$ 的浓度为 $0.1 mol/kg$,可以计算出 $Q$。
将这些值代入 Nernst 方程,计算出电动势 $E$。
(2) 对于 $Pt|Sn{Cl}_{2}(0.001mol/kg),Sn{Cl}_{4}(0.01mol/kg)|HFe{Cl}_{3}(0.01mol/(kg)),FeCl(0.001 mol/kg)|Pt$,需要计算标准电动势 $E^{\circ}$,$n$,$T$,$R$,$F$,以及反应商 $Q$。
(3) 对于 $Ag/Ag/{N}_{g}N{O}_{3}(0.1mol/kg)/{H}_{g}\times {N}_{3}(1mol/kg)\quad Ag$,需要计算标准电动势 $E^{\circ}$,$n$,$T$,$R$,$F$,以及反应商 $Q$。
(1) 电池类型:氢氧燃料电池
电极反应:负极:$2{H}_{2} + 4{OH}^{-} \rightarrow 4{H}_{2}O + 4{e}^{-}$
正极:${O}_{2} + 2{H}_{2}O + 4{e}^{-} \rightarrow 4{OH}^{-}$
步骤 2:计算电动势
电动势 $E$ 可以通过 Nernst 方程计算:
$E = E^{\circ} - \frac{RT}{nF} \ln Q$
其中,$E^{\circ}$ 是标准电动势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
步骤 3:计算电动势
(1) 对于氢氧燃料电池,标准电动势 $E^{\circ} = 1.229 V$,$n = 4$,$T = 298 K$,$R = 8.314 J/(mol\cdot K)$,$F = 96485 C/mol$。
反应商 $Q = \frac{[H_{2}O]^4}{[H_{2}]^2[O_{2}]}$,由于 $H_{2}$ 和 $O_{2}$ 的分压均为 $101325 Pa$,$HCl$ 的浓度为 $0.1 mol/kg$,可以计算出 $Q$。
将这些值代入 Nernst 方程,计算出电动势 $E$。
(2) 对于 $Pt|Sn{Cl}_{2}(0.001mol/kg),Sn{Cl}_{4}(0.01mol/kg)|HFe{Cl}_{3}(0.01mol/(kg)),FeCl(0.001 mol/kg)|Pt$,需要计算标准电动势 $E^{\circ}$,$n$,$T$,$R$,$F$,以及反应商 $Q$。
(3) 对于 $Ag/Ag/{N}_{g}N{O}_{3}(0.1mol/kg)/{H}_{g}\times {N}_{3}(1mol/kg)\quad Ag$,需要计算标准电动势 $E^{\circ}$,$n$,$T$,$R$,$F$,以及反应商 $Q$。