题目
空气-|||-b-|||-0 →=小华同学在实验室中进行铁丝在氧气中燃烧实验时,发现铁丝并没有燃烧,他对此异常现象感到好奇,于是在老师的指导下进行如下探究。铁丝在氧气中燃烧的化学方程式为 ____ 。【提出问题】铁丝为什么没有燃烧呢?【作出猜想】猜想一:铁丝表面有锈迹猜想二:氧气浓度太低【实验设计】小华同学分别进行如下实验:实验1:小华将原铁丝打磨光亮后充分加热,伸入原实验盛有氧气的集气瓶实验异常现象的探究中,观察到 ____ ,证明猜想一不成立。实验2:为进一步验证猜想二是否成立,小华同学制取并收集氧气体积分数为90%、80%、70%、60%、55%的气体各200mL,依次将长短相同、直径均为0.38mm的铁丝充分加热后分别伸入盛有上述气体的集气瓶中进行燃烧实验。实验现象如下表所示: O2体积分数 90% 80% 70% 60% 55% 实验现象 燃烧剧烈.燃烧时间长 燃烧剧烈程度比90%的弱,燃烧时间比90%的短 燃烧剧烈程度比80%的弱,燃烧时间比80%的短 燃烧剧烈程度比70%的弱,燃烧时间比70%的短 难以燃烧,只是红热 (1)由表格数据得出,猜想二 ____ (填“成立”或“不成立”)。(2)通过上述实验小华认为0.38mm的铁丝燃烧所需氧气的最低浓度为60%。你认为该结论 ____ (填“合理”或“不合理”),理由是 ____ 。【交流反思】(1)为了便于进行铁丝在氧气中燃烧的实验,收集氧气时应选择的方法是 ____ 。(2)实验中获得200mL气体样品的方法是:如图,先在250mL的集气瓶里装满水,塞紧橡胶塞并关闭止水夹b,打开止水夹a通入氧气,把瓶里的水排入量筒,当量筒内的水达到一定体积后关闭止水夹a,然后打开止水夹b通入空气,继续排水到量筒中水的体积为200mL为止。要获得氧气体积分数为80%的样品,则通入氧气排掉水的体积为 ____ (填序号,提示;空气中氧气的体积分数以(1)/(5)计算)mL。A.130B.140C.150D.160
 小华同学在实验室中进行铁丝在氧气中燃烧实验时,发现铁丝并没有燃烧,他对此异常现象感到好奇,于是在老师的指导下进行如下探究。铁丝在氧气中燃烧的化学方程式为 ____ 。
小华同学在实验室中进行铁丝在氧气中燃烧实验时,发现铁丝并没有燃烧,他对此异常现象感到好奇,于是在老师的指导下进行如下探究。铁丝在氧气中燃烧的化学方程式为 ____ 。【提出问题】铁丝为什么没有燃烧呢?
【作出猜想】
猜想一:铁丝表面有锈迹
猜想二:氧气浓度太低
【实验设计】小华同学分别进行如下实验:
实验1:小华将原铁丝打磨光亮后充分加热,伸入原实验盛有氧气的集气瓶实验异常现象的探究中,观察到 ____ ,证明猜想一不成立。
实验2:为进一步验证猜想二是否成立,小华同学制取并收集氧气体积分数为90%、80%、70%、60%、55%的气体各200mL,依次将长短相同、直径均为0.38mm的铁丝充分加热后分别伸入盛有上述气体的集气瓶中进行燃烧实验。实验现象如下表所示:
| O2体积分数 | 90% | 80% | 70% | 60% | 55% |
| 实验 现象 |
燃烧剧烈.燃 烧时间长 |
燃烧剧烈程度比90%的弱,燃烧时间比90%的短 | 燃烧剧烈程度比80%的弱,燃烧时间比80%的短 | 燃烧剧烈程度比70%的弱,燃烧时间比70%的短 | 难以燃烧,只 是红热 |
(2)通过上述实验小华认为0.38mm的铁丝燃烧所需氧气的最低浓度为60%。你认为该结论 ____ (填“合理”或“不合理”),理由是 ____ 。
【交流反思】
(1)为了便于进行铁丝在氧气中燃烧的实验,收集氧气时应选择的方法是 ____ 。
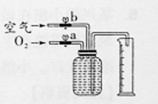
(2)实验中获得200mL气体样品的方法是:如图,先在250mL的集气瓶里装满水,塞紧橡胶塞并关闭止水夹b,打开止水夹a通入氧气,把瓶里的水排入量筒,当量筒内的水达到一定体积后关闭止水夹a,然后打开止水夹b通入空气,继续排水到量筒中水的体积为200mL为止。要获得氧气体积分数为80%的样品,则通入氧气排掉水的体积为 ____ (填序号,提示;空气中氧气的体积分数以$\frac{1}{5}$计算)mL。
A.130
B.140
C.150
D.160
题目解答
答案
解:铁和氧气在点燃条件下反应生成四氧化铁,书写化学方程式注意配平,所以化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
故答案为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4。
【实验设计】实验1:猜想一成立,则此时打磨的铁丝也会燃烧;
故答案为:铁丝没有燃烧。
实验2:(1)根据实验数据可以看出,氧气浓度不同,铁丝燃烧情况不同,所以猜想二成立;
故答案为:成立。
(2)实验设计的氧气浓度只有55%和60%,他们之间的浓度没有设计实验,所以不能断定60%是最低浓度,因此该结论不合理;
故答案为:不合理;在氧气浓度55%到60%之间没有进行测试,无法断定60%就是最低浓度。
【交流反思】(1)铁丝燃烧产生高温熔融物,所以需要留有少量水吸收热量,避免集气瓶炸裂,所以采用排水法收集气体;
故答案为:排水法。
(2)设通入氧气排掉水的体积为V,$\frac{(200mL-V)×\frac{1}{5}+V}{200}×100%$=80%,V=150mL;
故选:C。
故答案为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4。
【实验设计】实验1:猜想一成立,则此时打磨的铁丝也会燃烧;
故答案为:铁丝没有燃烧。
实验2:(1)根据实验数据可以看出,氧气浓度不同,铁丝燃烧情况不同,所以猜想二成立;
故答案为:成立。
(2)实验设计的氧气浓度只有55%和60%,他们之间的浓度没有设计实验,所以不能断定60%是最低浓度,因此该结论不合理;
故答案为:不合理;在氧气浓度55%到60%之间没有进行测试,无法断定60%就是最低浓度。
【交流反思】(1)铁丝燃烧产生高温熔融物,所以需要留有少量水吸收热量,避免集气瓶炸裂,所以采用排水法收集气体;
故答案为:排水法。
(2)设通入氧气排掉水的体积为V,$\frac{(200mL-V)×\frac{1}{5}+V}{200}×100%$=80%,V=150mL;
故选:C。