滴定方法是化学定量研究的常用方法。室温下,某学生实验小组向 (20 mL)、浓度均约为 0(. 1 mol)cdot ({{L)}^-1} 的盐酸和醋酸溶液中分别滴入 0.1000 mol⋅L−1 NaOH 标准溶液,记录溶液 (pH) 后绘制滴定曲线。配制 (100 mL 0)(. 100 mol)cdot ({{L)}^-1}(NaOH) 标准溶液所需玻璃仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要 。以下步骤合理的顺序为(用字母序号填写) 。A.向锥形瓶里注入 20(.00 mL) 待测 (HCl) 溶液,并滴入 2sim 3 滴酚酞B.用标准溶液润洗碱式滴定管 2sim 3 次C.固定好装标准溶液的碱式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡D.取标准 (NaOH) 溶液注入碱式滴定管至刻度 0 以上 2sim (3 cm)E.调节液面至 0 或 0 以下刻度,记下读数F.把锥形瓶放在滴定管下面,用标准 (NaOH) 溶液滴定至终点并记下滴定管液面刻度滴定管 (F),应该选择右图中滴定管 (填标号,下同)。排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。① ② ③-|||-甲 乙有位同学设计出如下实验记录表:V( (NaOH) )(/mL)0.005.0010.0015.0018.0019.0020.0021.0022.0023.0030.00(pH) 请简述此表内容设计的不足之处: 。实验结束,绘制的滴定曲线如图,下列说法正确的是 。① ② ③-|||-甲 乙A.曲线①表示 (NaOH) 溶液滴定盐酸时的 (pH) 变化B.两组实验滴定时都可选甲基橙作指示剂C.(a) 点 c( (C)({{H)}_3}(CO)({{O)}^-} )">:c(CH3COOH)>c(CH3COO−)D.(pH)=3 的 (C)({{H)}_3}(COOH) 溶液和 (pH)=11 的 (C)({{H)}_3}(COONa) 溶液,水的电离程度前者小于后者该实验中,下列操作中可能使所测 (HCl) 溶液的浓度数值偏低的是 。A.酸式滴定管未润洗就直接注入盐酸溶液B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥C.碱式滴定管在滴定前有气泡,滴定后气泡消失D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数乙二酸((HOOC)-(COOH),可简写为 ({{H)}_2}({{C)}_2}({{O)}_4})俗称草酸,易溶于水,属于二元中强酸。为探究草酸的部分化学性质,进行了如下实验:取某浓度的乙二酸溶液 25(.00 mL) 于锥形瓶中,滴加 0(.1000 mol)cdot ({{L)}^-1} 的酸性高锰酸钾溶液,发生反应 (KMn)({{O)}_4}+ ({{H)}_2}({{C)}_2}({{O)}_4}+ ({{H)}_2}(S)({{O)}_4}= (MnSO)_4^+ ({{K)}_2}(S)({{O)}_4}+ (C)({{O)}_2}uparrow + ({{H)}_2}(O)(请完成配平)。高锰酸钾标准液应盛放在 滴定管。当标准液滴至 20(.00 mL) 时,溶液 ,说明达到滴定终点,则此乙二酸的浓度为 (mol)cdot ({{L)}^-1},该滴定原理是利用了草酸的 性。该小组同学将 2(.52 g) 草酸晶体(({{H)}_2}({{C)}_2}({{O)}_4}cdot 2({{H)}_2}(O),摩尔质量 (126 g/mol))加入到 (100 mL 0)(.2 mol)cdot ({{L)}^-1} 的 (NaOH) 溶液中充分反应,测得反应后溶液呈酸性,其原因是 (用文字简单表述)。
滴定方法是化学定量研究的常用方法。
室温下,某学生实验小组向 $\text{20 mL}$、浓度均约为 $0\text{. 1 mol}\cdot {{\text{L}}^{-1}}$ 的盐酸和醋酸溶液中分别滴入 标准溶液,记录溶液 $\text{pH}$ 后绘制滴定曲线。
配制 $\text{100 mL 0}\text{. 100 mol}\cdot {{\text{L}}^{-1}}\text{NaOH}$ 标准溶液所需玻璃仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要 。
以下步骤合理的顺序为(用字母序号填写) 。
A.
向锥形瓶里注入 $20\text{.00 mL}$ 待测 $\text{HCl}$ 溶液,并滴入 $2\sim 3$ 滴酚酞
B.
用标准溶液润洗碱式滴定管 $2\sim 3$ 次
C.
固定好装标准溶液的碱式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡
D.
取标准 $\text{NaOH}$ 溶液注入碱式滴定管至刻度 $0$ 以上 $2\sim \text{3 cm}$
E.
调节液面至 $0$ 或 $0$ 以下刻度,记下读数
F.
把锥形瓶放在滴定管下面,用标准 $\text{NaOH}$ 溶液滴定至终点并记下滴定管液面刻度
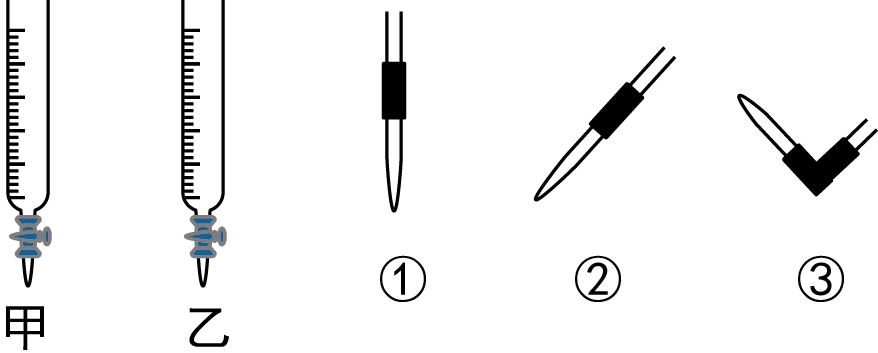
滴定管 $\text{F}$,应该选择右图中滴定管 (填标号,下同)。排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
有位同学设计出如下实验记录表:
$V\left( \text{NaOH} \right)\text{/mL}$ | $0.00$ | $5.00$ | $10.00$ | $15.00$ | $18.00$ | $19.00$ | $20.00$ | $21.00$ | $22.00$ | $23.00$ | $30.00$ |
$\text{pH}$ |
请简述此表内容设计的不足之处: 。
实验结束,绘制的滴定曲线如图,下列说法正确的是 。
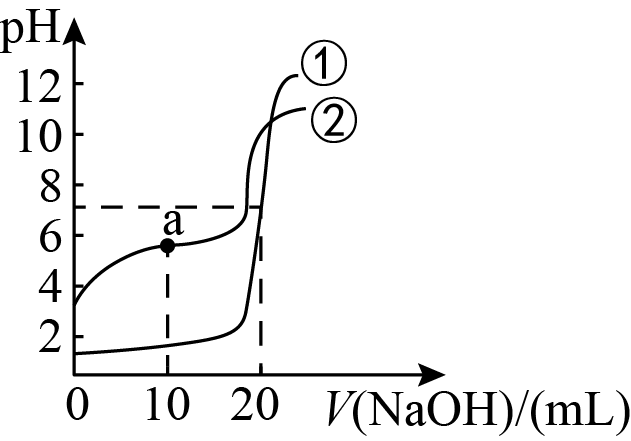
A.
曲线①表示 $\text{NaOH}$ 溶液滴定盐酸时的 $\text{pH}$ 变化
B.
两组实验滴定时都可选甲基橙作指示剂
C.
$\text{a}$ 点
D.
$\text{pH}=3$ 的 $\text{C}{{\text{H}}_3}\text{COOH}$ 溶液和 $\text{pH}=11$ 的 $\text{C}{{\text{H}}_3}\text{COONa}$ 溶液,水的电离程度前者小于后者
该实验中,下列操作中可能使所测 $\text{HCl}$ 溶液的浓度数值偏低的是 。
A.
酸式滴定管未润洗就直接注入盐酸溶液
B.
滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.
碱式滴定管在滴定前有气泡,滴定后气泡消失
D.
读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
乙二酸($\text{HOOC}-\text{COOH}$,可简写为 ${{\text{H}}_2}{{\text{C}}_2}{{\text{O}}_4}$)俗称草酸,易溶于水,属于二元中强酸。为探究草酸的部分化学性质,进行了如下实验:
取某浓度的乙二酸溶液 $25\text{.00 mL}$ 于锥形瓶中,滴加 $0\text{.1000 mol}\cdot {{\text{L}}^{-1}}$ 的酸性高锰酸钾溶液,发生反应 $\text{KMn}{{\text{O}}_4}+$ ${{\text{H}}_2}{{\text{C}}_2}{{\text{O}}_4}+$ ${{\text{H}}_2}\text{S}{{\text{O}}_4}=$ $\text{MnSO}_4^+$ ${{\text{K}}_2}\text{S}{{\text{O}}_4}+$ $\text{C}{{\text{O}}_2}\uparrow +$ ${{\text{H}}_2}\text{O}$(请完成配平)。
高锰酸钾标准液应盛放在 滴定管。当标准液滴至 $20\text{.00 mL}$ 时,溶液 ,说明达到滴定终点,则此乙二酸的浓度为 $\text{mol}\cdot {{\text{L}}^{-1}}$,该滴定原理是利用了草酸的 性。
该小组同学将 $2\text{.52 g}$ 草酸晶体(${{\text{H}}_2}{{\text{C}}_2}{{\text{O}}_4}\cdot 2{{\text{H}}_2}\text{O}$,摩尔质量 $\text{126 g/mol}$)加入到 $\text{100 mL 0}\text{.2 mol}\cdot {{\text{L}}^{-1}}$ 的 $\text{NaOH}$ 溶液中充分反应,测得反应后溶液呈酸性,其原因是 (用文字简单表述)。
题目解答
答案
- (1)
- (1)$\text{100 mL}$ 容量瓶
- (2)ABDCFE
- (3)①;③
- (4)此表未能体现出原始数据的结果;在突跃点处设置的检测点较少
- (5)A
- (6)A
- (2)
- (1)$2$;$5$;$3$;$2$;$+$;$10$;$8$
- (2)酸式;紫色变为无色且 $\text{30 s}$ 内不复色;$0.2$;还原
- (3)${{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}\cdot 2{{\text{H}}_{2}}\text{O}$ 为二元中强酸,滴定终点 $\text{NaH}{{\text{C}}_{2}}{{\text{O}}_{4}}$,$\text{H}{{\text{C}}_{2}}\text{O}_{4}^{-}$ 具有酸性,仍能电离出 ${{\text{H}}^{+}}$,因此溶液显酸性