题目
从对苯二甲酸(1mol)和乙二醇(1mol)聚酯化反应体系中,共分出水18克,求产物的平均分子量和反应程度,设平衡常数K=4。
从对苯二甲酸(1mol)和乙二醇(1mol)聚酯化反应体系中,共分出水18克,求产物的平均分子量和反应程度,设平衡常数K=4。
题目解答
答案
设分离出18g水后,反应达到平衡的反应程度为p,此时分子量为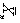 。
。
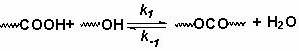
起始官能团数: N0 N0 0 0
t时刻官能团数:N0(1-P) N0(1-P) PN0 NW
残留水分子数=生成的水分子数-排出的水分子数:
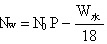
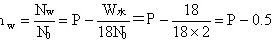
根据:
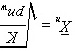 和
和 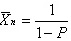
代入数据:
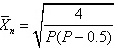 和
和 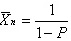
解得: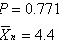
数均分子量: 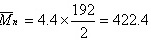
解析
步骤 1:确定反应物和生成物
对苯二甲酸和乙二醇反应生成聚酯和水。反应方程式为:
$\cdots \cdots COOH + \cdots \cdots OH \rightarrow \cdots \cdots CO\cdot O_{2} + H_{2}O$
步骤 2:计算反应程度
设反应程度为p,反应达到平衡时,剩余的对苯二甲酸和乙二醇的官能团数为N0(1-p),生成的聚酯的官能团数为PN0,生成的水分子数为NW。
残留水分子数=生成的水分子数-排出的水分子数:
$V_{水} = V_{2}P - \dfrac{W_{水}}{18}$
$I_{m} = \dfrac{N_{m}}{1.6} = P - \dfrac{1-1}{181.6} = P - \dfrac{18}{18 \times 2} = P - 0.5$
步骤 3:计算数均分子量
根据平衡常数K和反应程度p,可以计算出数均分子量:
$\overrightarrow{x_{n}} = \sqrt{\dfrac{4}{p(p-0.5)}}$
$\overline{I_{\lambda}} = \dfrac{1}{1-p}$
代入数据:
$\overrightarrow{p} = 0.771$
$\overline{I_{\lambda}} = 4.4$
数均分子量:
$\overrightarrow{u_{x}} = 4.4 \times \dfrac{192}{2} = 422.4$
对苯二甲酸和乙二醇反应生成聚酯和水。反应方程式为:
$\cdots \cdots COOH + \cdots \cdots OH \rightarrow \cdots \cdots CO\cdot O_{2} + H_{2}O$
步骤 2:计算反应程度
设反应程度为p,反应达到平衡时,剩余的对苯二甲酸和乙二醇的官能团数为N0(1-p),生成的聚酯的官能团数为PN0,生成的水分子数为NW。
残留水分子数=生成的水分子数-排出的水分子数:
$V_{水} = V_{2}P - \dfrac{W_{水}}{18}$
$I_{m} = \dfrac{N_{m}}{1.6} = P - \dfrac{1-1}{181.6} = P - \dfrac{18}{18 \times 2} = P - 0.5$
步骤 3:计算数均分子量
根据平衡常数K和反应程度p,可以计算出数均分子量:
$\overrightarrow{x_{n}} = \sqrt{\dfrac{4}{p(p-0.5)}}$
$\overline{I_{\lambda}} = \dfrac{1}{1-p}$
代入数据:
$\overrightarrow{p} = 0.771$
$\overline{I_{\lambda}} = 4.4$
数均分子量:
$\overrightarrow{u_{x}} = 4.4 \times \dfrac{192}{2} = 422.4$