题目
在温度为25 ℃及总压为101.3 kPa的条件下,使含二氧化碳为3.0%(体积分数)的混合空气与含二氧化碳为350 g/m3的水溶液接触。试判断二氧化碳的传递方向,并计算以二氧化碳的分压表示的总传质推动力。已知操作条件下,亨利系数=1.66times (10)^5kPa,水溶液的密度为997.8 kg/m3。
在温度为25 ℃及总压为101.3 kPa的条件下,使含二氧化碳为3.0%(体积分数)的混合空气与含二氧化碳为350 g/m3的水溶液接触。试判断二氧化碳的传递方向,并计算以二氧化碳的分压表示的总传质推动力。已知操作条件下,亨利系数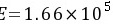 kPa,水溶液的密度为997.8 kg/m3。
kPa,水溶液的密度为997.8 kg/m3。
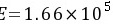 kPa,水溶液的密度为997.8 kg/m3。
kPa,水溶液的密度为997.8 kg/m3。题目解答
答案
解:水溶液中CO2的浓度为
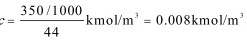
对于稀水溶液,总浓度为
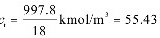 kmol/m3
kmol/m3水溶液中CO2的摩尔分数为
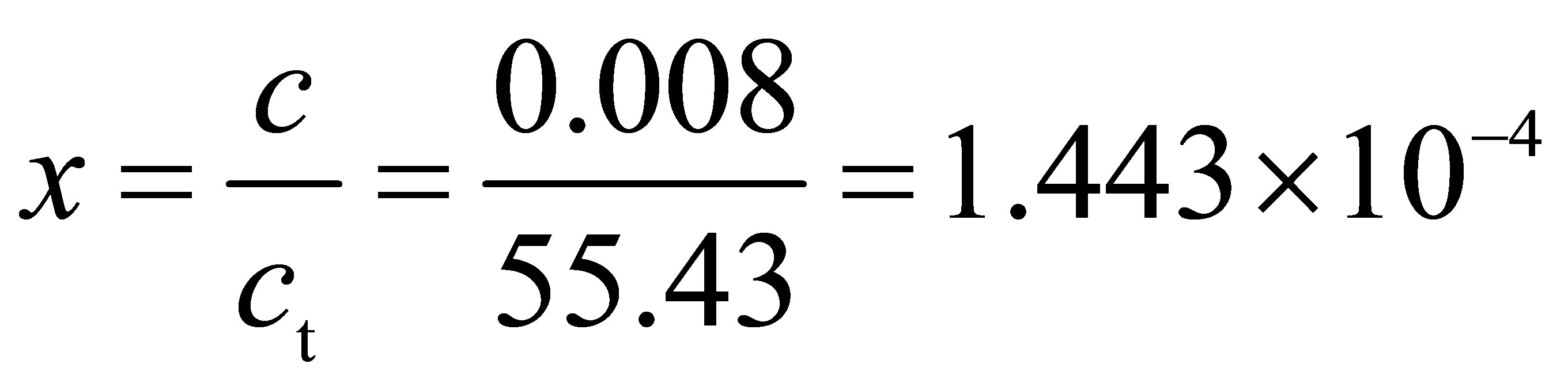
由 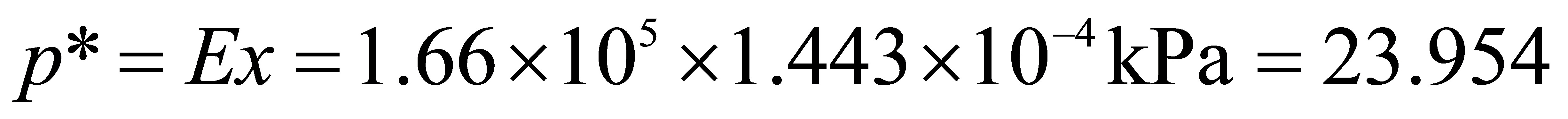 kPa
kPa
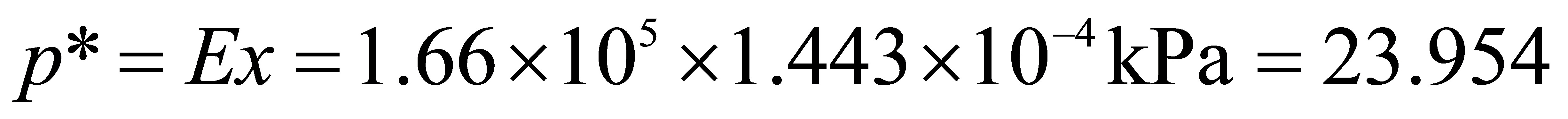 kPa
kPa气相中CO2的分压为
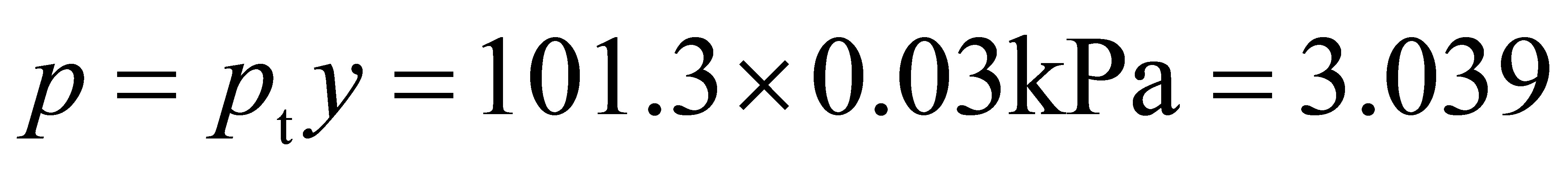 kPa <
kPa < 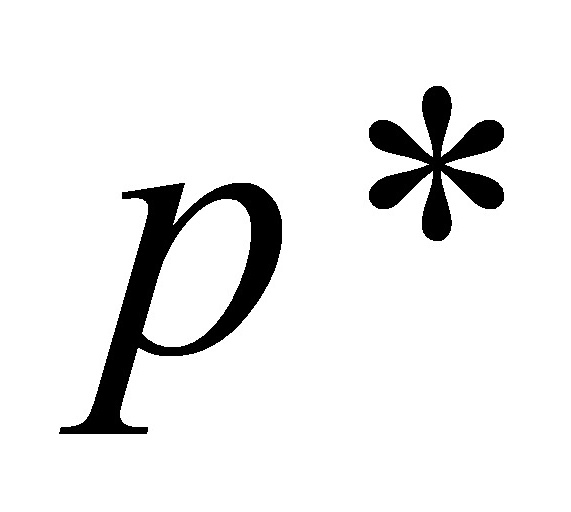
故CO2必由液相传递到气相,进行解吸。
以CO2的分压表示的总传质推动力为
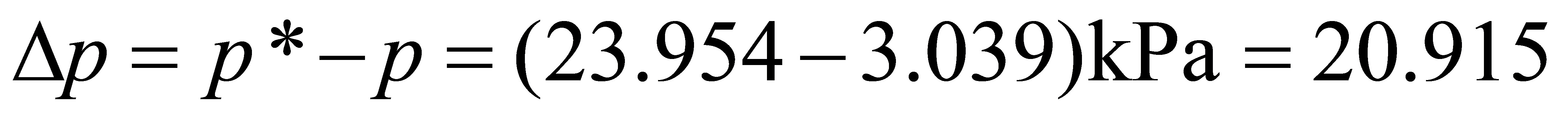 kPa
kPa解析
考查要点:本题主要考查传质方向的判断和总传质推动力的计算,涉及亨利定律的应用及分压差的计算。
解题核心思路:
- 判断传质方向:比较气相和液相中二氧化碳的分压,分压高的相向分压低的相传递。
- 计算总传质推动力:分压差即为总传质推动力。
破题关键点:
- 液相分压计算:利用亨利定律,需将溶液中CO₂的浓度转换为摩尔分数。
- 气相分压计算:直接通过体积分数与总压相乘得到。
- 单位换算:注意浓度单位(g/m³ → kmol/m³)及总浓度的计算。
1. 液相中CO₂的浓度与分压
计算CO₂的摩尔浓度
水溶液中CO₂的浓度为:
$c_{\text{CO}_2} = \frac{350 \, \text{g/m}^3}{44 \, \text{kg/kmol}} = 0.008 \, \text{kmol/m}^3$
计算水溶液的总浓度
水的总浓度为:
$c_{\text{总}} = \frac{997.8 \, \text{kg/m}^3}{18 \, \text{kg/kmol}} = 55.43 \, \text{kmol/m}^3$
计算CO₂的摩尔分数
$x_{\text{CO}_2} = \frac{c_{\text{CO}_2}}{c_{\text{总}}} = \frac{0.008}{55.43} = 1.443 \times 10^{-4}$
计算液相分压
根据亨利定律:
$p_L = E \cdot x_{\text{CO}_2} = 1.66 \times 10^5 \, \text{kPa} \times 1.443 \times 10^{-4} = 23.954 \, \text{kPa}$
2. 气相中CO₂的分压
气相分压为:
$p_G = p_{\text{总}} \cdot \text{体积分数} = 101.3 \, \text{kPa} \times 0.03 = 3.039 \, \text{kPa}$
3. 判断传质方向与总推动力
- 分压比较:$p_L = 23.954 \, \text{kPa} > p_G = 3.039 \, \text{kPa}$,故CO₂从液相传递到气相。
- 总传质推动力:
$\Delta p = p_L - p_G = 23.954 - 3.039 = 20.915 \, \text{kPa}$