题目
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法。(1)实验室制取气体时,确定发生装置需要考虑的两种因素有 ____ 。(填序号)A.反应物的状态 B.气体的密度 C.反应的条件 D.气体的溶解性(2)某实验的仪器柜里有如图仪器:如图1所示:止水夹-|||-单孔 双孔-|||-① ② ③ ④ ⑤ ⑥ ⑦-|||-图1实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是 ____ 。(填序号)(3)老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为 ____ 。为了完成该实验,有四位同学组装了以下发生装置,如图2所示,你认为最合适的一套装置是 ____ (填序号),该装置的最大优点是 ____ 。止水夹-|||-单孔 双孔-|||-① ② ③ ④ ⑤ ⑥ ⑦-|||-图1(4)某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液。他们的实验过程和相关数据如图3所示,请计算:止水夹-|||-单孔 双孔-|||-① ② ③ ④ ⑤ ⑥ ⑦-|||-图1①实验中生成沉淀的质量为 ____ g;②所得氢氧化钠溶液中溶质的质量分数。
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法。
(1)实验室制取气体时,确定发生装置需要考虑的两种因素有 ____ 。(填序号)
A.反应物的状态 B.气体的密度 C.反应的条件 D.气体的溶解性
(2)某实验的仪器柜里有如图仪器:如图1所示:
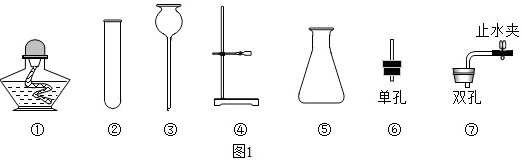
实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是 ____ 。(填序号)
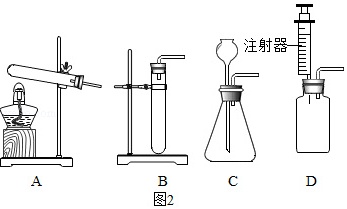
(3)老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为 ____ 。为了完成该实验,有四位同学组装了以下发生装置,如图2所示,你认为最合适的一套装置是 ____ (填序号),该装置的最大优点是 ____ 。
(4)某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液。他们的实验过程和相关数据如图3所示,请计算: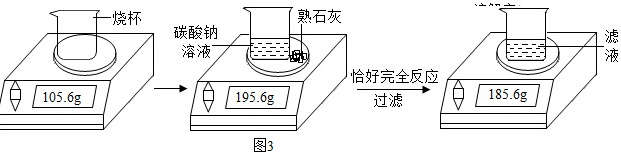
①实验中生成沉淀的质量为 ____ g;
②所得氢氧化钠溶液中溶质的质量分数。
(1)实验室制取气体时,确定发生装置需要考虑的两种因素有 ____ 。(填序号)
A.反应物的状态 B.气体的密度 C.反应的条件 D.气体的溶解性
(2)某实验的仪器柜里有如图仪器:如图1所示:

实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是 ____ 。(填序号)
(3)老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为 ____ 。为了完成该实验,有四位同学组装了以下发生装置,如图2所示,你认为最合适的一套装置是 ____ (填序号),该装置的最大优点是 ____ 。

(4)某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液。他们的实验过程和相关数据如图3所示,请计算:

①实验中生成沉淀的质量为 ____ g;
②所得氢氧化钠溶液中溶质的质量分数。
题目解答
答案
解:(1)因为发生装置的选定与反应物的状态和反应条件有关。如反应物是固体+液体反应,不需加热,属于固液常温型制取气体;反应物都是固体,且需要加热,属于固体加热型,需要选用有酒精灯等加热装置的装置。故确定某种气体的发生装置时,需要考虑的因素是反应物的状态和反应条件;故填:AC;
(2)实验室中制取二氧化碳常用大理石和稀盐酸反应来制取,属于固液常温型;二氧化碳密度比空气大,能溶于水,所以应用向上排空气法来收集二氧化碳。可能选择的仪器是①③④⑤;不需要进行加热,不可能选择的仪器是①;故填:①;
(3)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑,该反应的速率较快,为控制反应的速率,可选择图2中的装置D,通过注射器来控制反应的速率;
故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑;D;可以控制反应的速率;
(4)①根据质量守恒定律可得,生成的碳酸钙的质量为195.6g-185.6g=10g,故填:10;
②设生成的氢氧化钠的质量为x
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
100 80
10g x
$\frac{100}{10g}=\frac{80}{x}$
x=8g
则所得溶液中氢氧化钠的质量分数为$\frac{8g}{185.6g-105.6g}$×100%=10%
答:所得溶液中的溶质质量分数为10%。
(2)实验室中制取二氧化碳常用大理石和稀盐酸反应来制取,属于固液常温型;二氧化碳密度比空气大,能溶于水,所以应用向上排空气法来收集二氧化碳。可能选择的仪器是①③④⑤;不需要进行加热,不可能选择的仪器是①;故填:①;
(3)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑,该反应的速率较快,为控制反应的速率,可选择图2中的装置D,通过注射器来控制反应的速率;
故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑;D;可以控制反应的速率;
(4)①根据质量守恒定律可得,生成的碳酸钙的质量为195.6g-185.6g=10g,故填:10;
②设生成的氢氧化钠的质量为x
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
100 80
10g x
$\frac{100}{10g}=\frac{80}{x}$
x=8g
则所得溶液中氢氧化钠的质量分数为$\frac{8g}{185.6g-105.6g}$×100%=10%
答:所得溶液中的溶质质量分数为10%。
解析
步骤 1:确定发生装置需要考虑的因素
实验室制取气体时,确定发生装置需要考虑的两种因素有反应物的状态和反应条件。反应物的状态决定了反应是否需要加热,而反应条件则决定了是否需要加热或加压等。
步骤 2:选择合适的仪器
实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是①。因为制备二氧化碳不需要加热,所以不需要使用加热装置。
步骤 3:写出化学方程式
老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为Na_2CO_3+2HCl=2NaCl+H_2O+CO_2↑。为了完成该实验,有四位同学组装了以下发生装置,如图2所示,你认为最合适的一套装置是D,该装置的最大优点是可以控制反应的速率。
步骤 4:计算生成沉淀的质量
根据质量守恒定律可得,生成的碳酸钙的质量为195.6g-185.6g=10g。
步骤 5:计算氢氧化钠溶液中溶质的质量分数
设生成的氢氧化钠的质量为x
Ca(OH)_2+Na_2CO_3=CaCO_3↓+2NaOH
100 80
10g x
$\frac{100}{10g}=\frac{80}{x}$
x=8g
则所得溶液中氢氧化钠的质量分数为$\frac{8g}{185.6g-105.6g}$×100%=10%
实验室制取气体时,确定发生装置需要考虑的两种因素有反应物的状态和反应条件。反应物的状态决定了反应是否需要加热,而反应条件则决定了是否需要加热或加压等。
步骤 2:选择合适的仪器
实验室用大理石和稀盐酸制备并收集二氧化碳时,不可能选择的仪器是①。因为制备二氧化碳不需要加热,所以不需要使用加热装置。
步骤 3:写出化学方程式
老师提出用碳酸钠粉末与稀盐酸制取二氧化碳,其反应的化学方程式为Na_2CO_3+2HCl=2NaCl+H_2O+CO_2↑。为了完成该实验,有四位同学组装了以下发生装置,如图2所示,你认为最合适的一套装置是D,该装置的最大优点是可以控制反应的速率。
步骤 4:计算生成沉淀的质量
根据质量守恒定律可得,生成的碳酸钙的质量为195.6g-185.6g=10g。
步骤 5:计算氢氧化钠溶液中溶质的质量分数
设生成的氢氧化钠的质量为x
Ca(OH)_2+Na_2CO_3=CaCO_3↓+2NaOH
100 80
10g x
$\frac{100}{10g}=\frac{80}{x}$
x=8g
则所得溶液中氢氧化钠的质量分数为$\frac{8g}{185.6g-105.6g}$×100%=10%