题目
1.化学平衡常数-|||-(1)含义-|||-在一定 __ 下,当一个可逆反应达到 __ 时,生-|||-成物 __ 与反应物 __ 的比值是一个常数,简称平衡-|||-常数,用符号 __ 表示。化学平衡常数是指某一具体反应-|||-的平衡常数。-|||-(2)表达式-|||-对于一般的可逆反应 (g)+nB(g)leftharpoons PC(g)+gD(g), 在-|||-一定温度下达到平衡时,平衡常数的表达式:-|||-= __ -o-|||-①平衡常数表达式中,各物质的浓度均为平衡时的浓度。-|||-其书写形式与化学方程式的书写有关。-|||-②固体和纯液体的浓度视为常数,通常不计入平衡常数表-|||-达式中。-|||-(3)意义-|||-①K值越大,正反应进行的程度 __ 反应物的转化率-|||-__ 当 gt __ 时,可以认为反应进行得较完全。-|||-②K值越小,正反应进行的程度 __ 反应物的转化率-|||-__ 当 lt __ 时,认为反应很难进行。-|||-(4)影响因素-|||-①内因: __ 的性质。-|||-②外因:只受 __ 影响,与 __ __ 、-|||-__ 等外界因素无关。即在一定温度下,平衡常数保持-|||-不变。-|||-(5)平衡常数的应用-|||-①判断、比较可逆反应进行的程度-|||-一般来说,一定温度下的一个具体的可逆反应:-|||-K值-|||-正反应进行 平衡时生 平衡时反应 反应物-|||-的程度 成物浓度 物浓度 转化率-|||-越大 __ __ __ __-|||-越小 __ __ __ __-|||-②判断正在进行的可逆反应的方向以及反应是否达到平衡-|||-对于可逆反应: (g)+nB(g)leftharpoons PC(g)+gD(g), 若浓-|||-度商 _(c)=dfrac ({c)^p(C)cdot (c)^q(D)}({c)^m(A)cdot (c)^n(B)} 则将浓度商和平衡常数作比较可得-|||-可逆反应所处的状态。1.化学平衡常数-|||-(1)含义-|||-在一定 __ 下,当一个可逆反应达到 __ 时,生-|||-成物 __ 与反应物 __ 的比值是一个常数,简称平衡-|||-常数,用符号 __ 表示。化学平衡常数是指某一具体反应-|||-的平衡常数。-|||-(2)表达式-|||-对于一般的可逆反应 (g)+nB(g)leftharpoons PC(g)+gD(g), 在-|||-一定温度下达到平衡时,平衡常数的表达式:-|||-= __ -o-|||-①平衡常数表达式中,各物质的浓度均为平衡时的浓度。-|||-其书写形式与化学方程式的书写有关。-|||-②固体和纯液体的浓度视为常数,通常不计入平衡常数表-|||-达式中。-|||-(3)意义-|||-①K值越大,正反应进行的程度 __ 反应物的转化率-|||-__ 当 gt __ 时,可以认为反应进行得较完全。-|||-②K值越小,正反应进行的程度 __ 反应物的转化率-|||-__ 当 lt __ 时,认为反应很难进行。-|||-(4)影响因素-|||-①内因: __ 的性质。-|||-②外因:只受 __ 影响,与 __ __ 、-|||-__ 等外界因素无关。即在一定温度下,平衡常数保持-|||-不变。-|||-(5)平衡常数的应用-|||-①判断、比较可逆反应进行的程度-|||-一般来说,一定温度下的一个具体的可逆反应:-|||-K值-|||-正反应进行 平衡时生 平衡时反应 反应物-|||-的程度 成物浓度 物浓度 转化率-|||-越大 __ __ __ __-|||-越小 __ __ __ __-|||-②判断正在进行的可逆反应的方向以及反应是否达到平衡-|||-对于可逆反应: (g)+nB(g)leftharpoons PC(g)+gD(g), 若浓-|||-度商 _(c)=dfrac ({c)^p(C)cdot (c)^q(D)}({c)^m(A)cdot (c)^n(B)} 则将浓度商和平衡常数作比较可得-|||-可逆反应所处的状态。

题目解答
答案

解析
步骤 1:化学平衡常数的定义
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,简称平衡常数,用符号K表示。化学平衡常数是指某一具体反应的平衡常数。
步骤 2:平衡常数的表达式
对于一般的可逆反应 $mA(g)+nB(g)\rightleftharpoons PC(g)+qD(g)$,在一定温度下达到平衡时,平衡常数的表达式为:$K=\dfrac {{C}^{p}(C)\cdot {C}^{q}(D)}{{C}^{m}(A)\cdot {C}^{n}(B)}$。其中,各物质的浓度均为平衡时的浓度。其书写形式与化学方程式的书写有关。固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
步骤 3:平衡常数的意义
①K值越大,正反应进行的程度越大,反应物的转化率越高。当 $K\gt 10^5$ 时,可以认为反应进行得较完全。
②K值越小,正反应进行的程度越小,反应物的转化率越低。当 $K\lt 10^{-5}$ 时,认为反应很难进行。
步骤 4:平衡常数的影响因素
①内因:反应物本身的性质。
②外因:只受温度影响,与浓度、压强、催化剂等外界因素无关。即在一定温度下,平衡常数保持不变。
步骤 5:平衡常数的应用
①判断、比较可逆反应进行的程度
一般来说,一定温度下的一个具体的可逆反应:K值越大,正反应进行的程度越大,平衡时生成物浓度越高,反应物浓度越低,反应物的转化率越高。K值越小,正反应进行的程度越小,平衡时生成物浓度越低,反应物浓度越高,反应物的转化率越低。
②判断正在进行的可逆反应的方向以及反应是否达到平衡
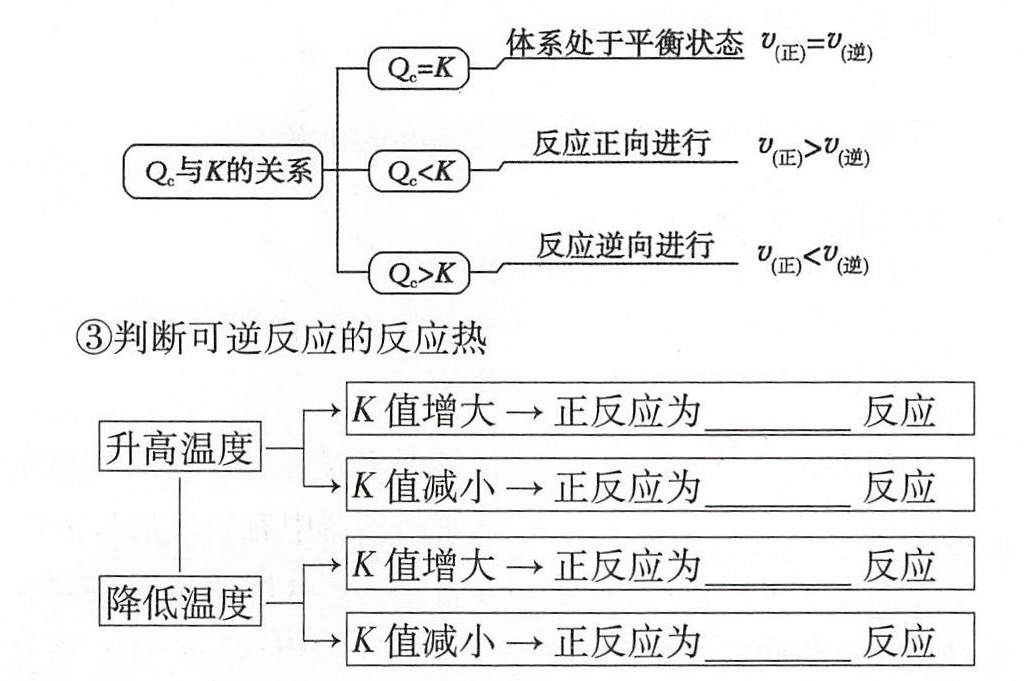
对于可逆反应:$mA(g)+nB(g)\rightleftharpoons PC(g)+qD(g)$,若浓度商 ${Q}_{c}=\dfrac {{C}^{p}(C)\cdot {C}^{q}(D)}{{C}^{m}(A)\cdot {C}^{n}(B)}$,则将浓度商和平衡常数作比较可得可逆反应所处的状态。${Q}_{C}=K$ 一 体系处于平衡状态 ${V}_{(IE)}={V}_{2}$ (逆) 反应正向进行 ${V}_{(II)}\gt {V}_{(边)}$ Q0与K的关系 ${Q}_{C}\lt K$ 一 C ${Q}_{C}\gt K$ ) 反应逆向进行 ${v}_{(IE)}\lt v$ (逆)
③判断可逆反应的反应热
K值增大→正反应为吸热反应 升高温度 K值减小→正反应为放热反应 K值增大→正反应为放热反应 降低温度 K值减小→正反应为吸热反应
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,简称平衡常数,用符号K表示。化学平衡常数是指某一具体反应的平衡常数。
步骤 2:平衡常数的表达式
对于一般的可逆反应 $mA(g)+nB(g)\rightleftharpoons PC(g)+qD(g)$,在一定温度下达到平衡时,平衡常数的表达式为:$K=\dfrac {{C}^{p}(C)\cdot {C}^{q}(D)}{{C}^{m}(A)\cdot {C}^{n}(B)}$。其中,各物质的浓度均为平衡时的浓度。其书写形式与化学方程式的书写有关。固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
步骤 3:平衡常数的意义
①K值越大,正反应进行的程度越大,反应物的转化率越高。当 $K\gt 10^5$ 时,可以认为反应进行得较完全。
②K值越小,正反应进行的程度越小,反应物的转化率越低。当 $K\lt 10^{-5}$ 时,认为反应很难进行。
步骤 4:平衡常数的影响因素
①内因:反应物本身的性质。
②外因:只受温度影响,与浓度、压强、催化剂等外界因素无关。即在一定温度下,平衡常数保持不变。
步骤 5:平衡常数的应用
①判断、比较可逆反应进行的程度
一般来说,一定温度下的一个具体的可逆反应:K值越大,正反应进行的程度越大,平衡时生成物浓度越高,反应物浓度越低,反应物的转化率越高。K值越小,正反应进行的程度越小,平衡时生成物浓度越低,反应物浓度越高,反应物的转化率越低。
②判断正在进行的可逆反应的方向以及反应是否达到平衡
对于可逆反应:$mA(g)+nB(g)\rightleftharpoons PC(g)+qD(g)$,若浓度商 ${Q}_{c}=\dfrac {{C}^{p}(C)\cdot {C}^{q}(D)}{{C}^{m}(A)\cdot {C}^{n}(B)}$,则将浓度商和平衡常数作比较可得可逆反应所处的状态。${Q}_{C}=K$ 一 体系处于平衡状态 ${V}_{(IE)}={V}_{2}$ (逆) 反应正向进行 ${V}_{(II)}\gt {V}_{(边)}$ Q0与K的关系 ${Q}_{C}\lt K$ 一 C ${Q}_{C}\gt K$ ) 反应逆向进行 ${v}_{(IE)}\lt v$ (逆)
③判断可逆反应的反应热
K值增大→正反应为吸热反应 升高温度 K值减小→正反应为放热反应 K值增大→正反应为放热反应 降低温度 K值减小→正反应为吸热反应