8-7 计算下列转化反应的平衡常数,并判断转化反应能否进行?-|||-(1) ([ Cu{(N{H)_(3))}_(2)] }^++2CN=!=!= ([ Cu{(CN))_(2)] }^-+2N(H)_(3)-|||-(2)[Cu(NH (H{S)_(3))}_(4)^2++(Zn)^2+=!=!= ([ Zn{(N{H)_(3))}_(4)] }^2++(Cu)^2+-|||-(3) [ ([ u{(N{H)_(3))}_(4)] }^2++4(H)^+=!=!= 4(N{H)_(4)}^++(Cu)^2+-|||-(4) ([ {Ag{({S)_(2)(O)_(3))}_(2)] }^3-+(Cl)^-=!=!= AgCldownarrow +2({S)_(2)(O)_(3)}^2-

题目解答
答案
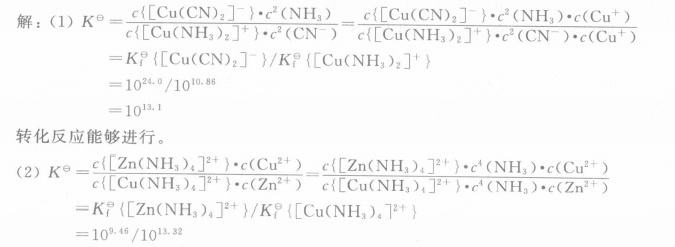

解析
本题考查化学平衡常数的计算以及根据平衡常数判断反应能否进行的知识。解题思路是先根据化学反应写出平衡常数的表达式,再结合已知的稳定常数或溶度积等数据进行计算,最后根据计算得到的平衡常数大小判断反应能否进行。
(1)对于反应 ${[ Cu{(N{H}_{3})}_{2}] }^{+}+2CN=\!=\!= {[ Cu{(CN)}_{2}] }^{-}+2N{H}_{3}$
平衡常数表达式为:
$K^{e}=\frac{c{[Cu(CN)_{2}]}^{-}\cdot c^{2}(NH_{3})}{c{[Cu(NH_{3})_{2}]}^{+}\cdot c^{2}(CN^{-})}$
已知$K_{P}\{ {[ Cu{(CN)}_{2}] }^{-}\}=10^{24.0}$,$K_{P}\{ {[ Cu{(N{H}_{3})}_{2}] }^{+}\}=10^{10.86}$
则$K^{e}=\frac{K_{P}\{ {[ Cu{(CN)}_{2}] }^{-}\}}{K_{P}\{ {[ Cu{(N{H}_{3})}_{2}] }^{+}\}}=\frac{10^{24.0}}{10^{10.86}} = 10^{13.1}$
因为$K^{e}= 10^{13.1}>1$,所以转化反应能够进行。
(2)对于反应$[Cu(NH_{3})_{4}]^{2+}+{Zn}^{2+}=\!=\!= {[ Zn{(N{H}_{3})}_{4}] }^{2+}+{Cu}^{2+}$
平衡常数表达式为:
$K^{e}=\frac{c{[Zn(NH_{3})_{4}]}^{2+}\cdot c(Cu^{2+})}{c{[Cu(NH_{3})_{4}]}^{2+}\cdot c(Zn^{2+})}$
已知$K_{P}\{ {[ Zn{(N{H}_{3})}_{4}] }^{2+}\}=10^{9.46}$,$K_{P}\{ {[ Cu{(N{H}_{3})}_{4}] }^{2+}\}=10^{13.32}$
则$K^{e}=\frac{K_{P}\{ {[ Zn{(N{H}_{3})}_{4}] }^{2+}\}}{K_{P}\{ {[ Cu{(N{H}_{3})}_{4}] }^{2+}\}}=\frac{10^{9.46}}{10^{13.32}} = 10^{-3.86}$
因为$K^{e}= 10^{-3.86}<1$,所以转化反应不能够进行。
(3)对于反应$[ {[ Cu{(N{H}_{3})}_{4}] }^{2+}+4{H}^{+}=\!=\!= 4N{H}_{4}^{+}+{Cu}^{2+}$
平衡常数表达式为:
$K^{e}=\frac{c^{4}(NH_{4}^{+})\cdot c(Cu^{2+})}{c{[Cu(NH_{3})_{4}]}^{2+}\cdot c^{4}(H^{+})}$
已知$K_{a}\{ {NH_{4}}^{+}\}=5.6\times 10^{-10}$,$K_{P}\{ {[ Cu{(N{H}_{3})}_{4}] }^{2+}\}=10^{13.32}$
则$K^{e}=\frac{1}{K_{a}\{ {NH_{4}}^{+}\}\cdot K_{P}\{ {[ Cu{(N{H}_{3})}_{4}] }^{2+}\}}=\frac{1}{5.6\times 10^{-10}\times 10^{13.32}} = 1.7\times 10^{-4}$
因为$K^{e}= 1.7\times 10^{-4}<1$,所以转化反应不能够进行。
(4)对于反应${[ {Ag{({S}_{2}{O}_{3})}_{2}] }^{3-}+{Cl}^{-}=\!=\!= AgCl\downarrow +2{{S}_{2}{O}_{3}}^{2-}$
平衡常数表达式为:
$K^{e}=\frac{c{[Ag(S_{2}O_{3})_{2}]}^{3-}\cdot c(Cl^{-})}{c^{2}(S_{2}O_{3}^{2-})}$
已知$K_{sp}(AgCl)=1.8\times 10^{-10}$,$K_{P}\{ {[ Ag{({S}_{2}{O}_{3})}_{2}] }^{3-}\}=10^{13.46}$
则$K^{e}=\frac{1}{K_{sp}(AgCl)\cdot K_{P}\{ {[ Ag{({S}_{2}{O}_{3})}_{2}] }^{3-}\}}=\frac{1}{1.8\times 10^{-10}\times 10^{13.46}} = 5.0\times 10^{-4}$
因为$K^{e}= 5.0\times 10^{-4}<1$,所以转化反应不能够进行。