碳是地球上组成生命的最基本元素之一,可以ds、ds和ds杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题: ds基态碳原子核外有____种空间运动状态的电子,其价电子排布图为_____________。ds光气的分子式为ds,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为________,其碳原子杂化轨道类型为________杂化。 ds碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示: 碳酸盐 ds ds ds ds 热分解温度ds 402 900 1172 1360 阳离子半径ds 66 99 112 135 试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?_____________________。ds碳的一种同素异形体ds,又名足球烯,是一种高度对称的球碳分子。立方烷ds分子式:ds,结构如立方体:dsds是比ds约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与ds的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原ds晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为___________。dsds碳的另一种同素异形体ds石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________个。已知石墨的密度为ds,ds键长为ds,阿伏伽德罗常数的值为ds,计算石墨晶体的层间距为________ds。ds碳的第三种同素异形体ds金刚石,其晶胞如上图所示。已知金属钠的晶胞ds体心立方堆积ds沿其体对角线垂直在纸平面上的投影图如下图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图_______ds从ds图中选填ds。ds ds化学ds选修3:物质结构与性质ds2018年7月5日ds科学ds杂志在线报道:美国研究人员合成一种新的具有超高热导率半导体材料砷化硼ds。回答下列问题:ds基态As原子价层电子的电子排布图ds轨道表达式ds为________,基态B原子核外电子占据最高能级的电子云轮廓图为________。ds通过反应ds,晶体ds可制备BAs晶体,ds结构如图ds所示。dsds分子空间构型为________,其中B原子杂化方式是________。ds分子中键角为________度,分子中成键电子对与孤电子对数目之比为________。ds晶态单质硼有多种结构,它们都以ds结构如图ds所示ds为基本的结构单元。ds结构单元为________面体。单质硼的熔点为ds,它属于________晶体。ds晶胞结构如图ds所示,已知晶胞参数为ds,阿伏加德罗常数的值为ds。As原子的配位数为________;BAs晶体的密度为________ds列出计算式ds。 ds化学ds物质结构与性质ds 氮、铬及其相关化合物用途非常广泛:回答下列问题:ds基态N原子的核外电子排布式为_________,Cr位于元素周期表第四周期________族。ds与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为_________;ds的熔点ds比ds的熔点ds低得多,这是因为_______________________________。ds的一种配合物结构如图所示:dsds阴离子ds的空间构型为_______形。ds配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为________键。ds配体ds乙二胺ds中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为____________。ds氮化铬的熔点为ds,它的一种晶体的晶胞结构如图所示,其密度为ds,氮化铬的晶胞边长为____________ds列出计算式ds。ds 铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:ds铁、钴、镍的基态原子核外未成对电子数最多的是________。ds酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______ds填1、2、3、ds,三种非金属原子的电负性由大到小的顺序为_____________ds用相应的元素符号表示ds;氮原子的杂化轨道类型为_________________。dsds,常温下呈液态,熔点为ds,沸点为ds,易溶于非极性溶剂,据此可判断ds,晶体属于__________ds填晶体类型ds,若配合物ds的中心原子价电子数与配体提供电子数之和为18,则ds_______。ds、FeO的晶体结构类型与氯化钠的相同,ds和ds的离子半径分别为69pm和78pm,则熔点NiO____ds填“ds”“ds”或“ds”ds,原因是____________。ds的晶胞结构如图所示:dsds镍离子的配位数为__________。ds若阿伏加德罗常数的值为ds,晶体密度为ds,则该晶胞中最近的ds之间的距离为______cm。ds写出计算表达式ds 【化学ds选修3:物质结构与性质】第ⅢA族元素及其化合物广泛应用于材料科学。请回答下列问题: ds ds基态B原子的核外电子排布图为________。ds是新型无机非金属材料。同周期元素中第一电离能处于B和N之间ds不包括B和ds有________种元素,其中电负性最大的元素的基态原子核外电子占据________个能级。ds、ds是有机合成中常用的还原剂。ds可由硼酸制得,硼酸的结构如图1所示。ds硼酸中,1个B原子与相邻3个O原子构成的形状是________ds填空间构型名称ds。ds硼酸晶体中不存在的作用力类型有________ds填字母ds。ds范德华力 ds氢键 c.ds键 d.ds键ds是一元弱酸,在水中电离方程式为ds,ds中B原子的杂化方式为________。ds根据对角线规则,B和________ds填元素符号ds的性质相似。ds某镁铝合金的晶胞为立方结构,其结构如图2所示,该晶体中Al原子的配位数为________。ds、GaN的结构均与金刚石相似,GaAs的熔点低于GaN的主要原因为________。ds砷化镓晶胞结构如图3所示。已知:砷化镓晶体密度为d ds,阿伏加德罗常数的值为ds。ds连接面心上6个砷原子构成正八面体,该正八面体的边长为________ds用含d和ds的代数式表示ds。ds和As之间的最近距离为________ds用含d和ds的代数式表示ds。 【化学ds选修3:物质结构与性质】教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:ds图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有________种,其中原子序数最大的基态原子的外围电子排布式为________。ds图一ds图二中,每条折线代表周期表中ds某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为________;与x点对应的简单氢化物互为等电子体的离子为________ds写一种ds。ds图二ds图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与ds形成的化学键类型为________;5号C原子和6号C原子的杂化方式分别为________、________;该分子中所含非金属元素的电负性由小到大的顺序为________。ds图三ds从石墨晶体结构示意图中截取石墨的晶胞如图四所示,设阿伏加德罗常数为ds,已知ds,石墨晶体的密度为________ds列出计算式ds。ds图四 ds化学ds选修3:物质结构与性质ds ds、ds和ds均可用作电极材料。请回答下列问题:ds基态ds的价层电子轨道表达式为________________;同周期元素中,基态原子的未成对电子数与基态ds相同的元素为________。ds的空间构型为________________,其中P原子的杂化方式为________;写出一种与ds互为等电子体且中心原子与P不同主族的阴离子:________ds填离子符号ds。ds为紫色晶体,其中1mol阳离子中所含ds键的数目为________;配位键中提供孤电子对的原子为________ds填元素符号ds。ds已知物质间的转化关系如图甲所示,其中a、c均大于0。dsds基态Na原子的第一电离能可表示为________。ds相同条件下,ds的晶格能________ds填“ds”“ds”或“ds”ds,原因为________________________________________________________________________。ds的立方晶胞结构如图乙所示。若紧邻的两个ds之间的距离为dpm,阿伏加德罗常数的值为ds,晶体的密度为ds,则Na的摩尔质量可表示为________________ds用含有d、ds、ds的代数式表示ds。 据报道,某科研团队成功合成了钛掺杂、镧镍锂氧化物包覆的“双重修饰”富镍三元正极材料。请回答下列问题:ds基态钛原子的外围电子排布图为____________。ds是一种还原剂,可将羧酸直接还原为醇:dsdsds。ds中存在的作用力类型有_____ds填字母ds。ds离子键ds配位键ds氢键ds非极性键ds乙醚ds、乙醇的沸点分别为ds、ds,导致二者沸点差异的主要原因是___________________________。ds分子中C原子的杂化方式为_______;所含ds键和ds键的数目之比为_____;键角ds____ds填“ds”“ds”或“ds”ds。dsds的晶胞结构如图甲所示,其中白球代表__ds填“Ti”或“O”ds,黑球的配位数为____。dsds氧化镍的立方晶胞结构如图乙所示。已知氧化镍晶体的密度为ds,ds为阿伏加德罗常数的值。dsds坐标参数表示原子在晶体中的相对位置。已知A、B的坐标参数分别为ds0,ds、ds1,ds,则C的坐标参数为_________。ds晶胞面心上的6个氧离子构成正八面体形,镍离子位于体心,该正八面体的边长为_____ds用含有d、ds的代数式表示ds。 第四周期某些过渡元素在工业生产中有着极其重要的作用dsds铬是最硬的金属单质,被称为“不锈钢的添加剂”ds写出Cr在周期表中的位置________;其原子核外电子排布的最高能层符号________dsds在ds其中Cr为ds价ds中,含有过氧键的数目为________
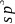 、
、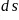 和
和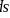 杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:  基态碳原子核外有____种空间运动状态的电子,其价电子排布图为_____________。
基态碳原子核外有____种空间运动状态的电子,其价电子排布图为_____________。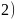 光气的分子式为
光气的分子式为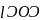 ,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为________,其碳原子杂化轨道类型为________杂化。
,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为________,其碳原子杂化轨道类型为________杂化。 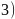 碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
-
碳酸盐
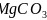
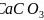
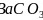
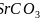
热分解温度
402
900
1172
1360
阳离子半径
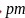
66
99
112
135
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?_____________________。 碳的一种同素异形体
碳的一种同素异形体 ,又名足球烯,是一种高度对称的球碳分子。立方烷
,又名足球烯,是一种高度对称的球碳分子。立方烷 分子式:
分子式: ,结构如立方体:
,结构如立方体: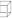
 是比
是比 约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与
约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与 的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原
的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原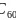 晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为___________。
晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为___________。
 碳的另一种同素异形体
碳的另一种同素异形体 石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________个。已知石墨的密度为
石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________个。已知石墨的密度为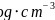 ,
,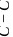 键长为
键长为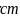 ,阿伏伽德罗常数的值为
,阿伏伽德罗常数的值为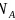 ,计算石墨晶体的层间距为________
,计算石墨晶体的层间距为________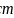 。
。 碳的第三种同素异形体
碳的第三种同素异形体 金刚石,其晶胞如上图所示。已知金属钠的晶胞
金刚石,其晶胞如上图所示。已知金属钠的晶胞 体心立方堆积
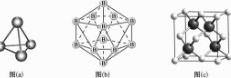
体心立方堆积 沿其体对角线垂直在纸平面上的投影图如下图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图_______
沿其体对角线垂直在纸平面上的投影图如下图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图_______ 从
从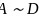 图中选填
图中选填 。
。
 化学
化学 选修3:物质结构与性质
选修3:物质结构与性质
2018年7月5日 科学
科学 杂志在线报道:美国研究人员合成一种新的具有超高热导率半导体材料砷化硼
杂志在线报道:美国研究人员合成一种新的具有超高热导率半导体材料砷化硼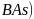 。回答下列问题:
。回答下列问题:
 基态As原子价层电子的电子排布图
基态As原子价层电子的电子排布图 轨道表达式
轨道表达式 为________,基态B原子核外电子占据最高能级的电子云轮廓图为________。
为________,基态B原子核外电子占据最高能级的电子云轮廓图为________。
 通过反应
通过反应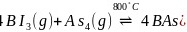 ,晶体
,晶体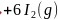 可制备BAs晶体,
可制备BAs晶体, 结构如图
结构如图 所示。
所示。
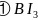 分子空间构型为________,其中B原子杂化方式是________。
分子空间构型为________,其中B原子杂化方式是________。
 分子中键角为________度,分子中成键电子对与孤电子对数目之比为________。
分子中键角为________度,分子中成键电子对与孤电子对数目之比为________。
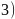 晶态单质硼有多种结构,它们都以
晶态单质硼有多种结构,它们都以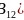 结构如图
结构如图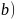 所示
所示 为基本的结构单元。
为基本的结构单元。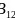 结构单元为________面体。单质硼的熔点为
结构单元为________面体。单质硼的熔点为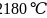 ,它属于________晶体。
,它属于________晶体。
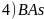 晶胞结构如图
晶胞结构如图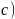 所示,已知晶胞参数为
所示,已知晶胞参数为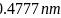 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为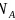 。As原子的配位数为________;BAs晶体的密度为________
。As原子的配位数为________;BAs晶体的密度为________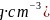 列出计算式
列出计算式 。
。
 化学
化学 物质结构与性质
物质结构与性质
氮、铬及其相关化合物用途非常广泛:回答下列问题:
 基态N原子的核外电子排布式为_________,Cr位于元素周期表第四周期________族。
基态N原子的核外电子排布式为_________,Cr位于元素周期表第四周期________族。
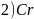 与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为_________;
与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为_________;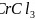 的熔点
的熔点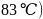 比
比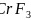 的熔点
的熔点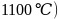 低得多,这是因为_______________________________。
低得多,这是因为_______________________________。
 的一种配合物结构如图所示:
的一种配合物结构如图所示: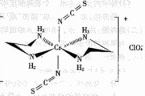
 阴离子
阴离子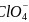 的空间构型为_______形。
的空间构型为_______形。
 配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为________键。
配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为________键。
 配体
配体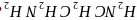 乙二胺
乙二胺 中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为____________。
中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为____________。
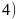 氮化铬的熔点为
氮化铬的熔点为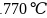 ,它的一种晶体的晶胞结构如图所示,其密度为
,它的一种晶体的晶胞结构如图所示,其密度为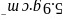 ,氮化铬的晶胞边长为____________
,氮化铬的晶胞边长为____________ 列出计算式
列出计算式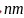 。
。
铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
 铁、钴、镍的基态原子核外未成对电子数最多的是________。
铁、钴、镍的基态原子核外未成对电子数最多的是________。
 酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______
酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______ 填1、2、3、
填1、2、3、 ,三种非金属原子的电负性由大到小的顺序为_____________
,三种非金属原子的电负性由大到小的顺序为_____________ 用相应的元素符号表示
用相应的元素符号表示 ;氮原子的杂化轨道类型为_________________。
;氮原子的杂化轨道类型为_________________。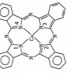
 ,常温下呈液态,熔点为
,常温下呈液态,熔点为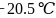 ,沸点为
,沸点为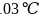 ,易溶于非极性溶剂,据此可判断
,易溶于非极性溶剂,据此可判断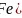 ,晶体属于__________
,晶体属于__________ 填晶体类型
填晶体类型 ,若配合物
,若配合物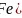 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则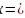 _______。
_______。
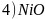 、FeO的晶体结构类型与氯化钠的相同,
、FeO的晶体结构类型与氯化钠的相同,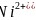 和
和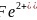 的离子半径分别为69pm和78pm,则熔点NiO____
的离子半径分别为69pm和78pm,则熔点NiO____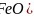 填“
填“ ”“
”“ ”或“
”或“ ”
” ,原因是____________。
,原因是____________。
 的晶胞结构如图所示:
的晶胞结构如图所示: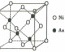
 镍离子的配位数为__________。
镍离子的配位数为__________。
 若阿伏加德罗常数的值为
若阿伏加德罗常数的值为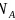 ,晶体密度为
,晶体密度为 ,则该晶胞中最近的
,则该晶胞中最近的 之间的距离为______cm。
之间的距离为______cm。 写出计算表达式
写出计算表达式
【化学
 选修3:物质结构与性质】第ⅢA族元素及其化合物广泛应用于材料科学。请回答下列问题:
选修3:物质结构与性质】第ⅢA族元素及其化合物广泛应用于材料科学。请回答下列问题: 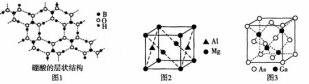
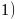 基态B原子的核外电子排布图为________。
基态B原子的核外电子排布图为________。
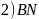 是新型无机非金属材料。同周期元素中第一电离能处于B和N之间
是新型无机非金属材料。同周期元素中第一电离能处于B和N之间 不包括B和
不包括B和 有________种元素,其中电负性最大的元素的基态原子核外电子占据________个能级。
有________种元素,其中电负性最大的元素的基态原子核外电子占据________个能级。
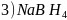 、
、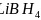 是有机合成中常用的还原剂。
是有机合成中常用的还原剂。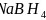 可由硼酸制得,硼酸的结构如图1所示。
可由硼酸制得,硼酸的结构如图1所示。
 硼酸中,1个B原子与相邻3个O原子构成的形状是________
硼酸中,1个B原子与相邻3个O原子构成的形状是________ 填空间构型名称
填空间构型名称 。
。
 硼酸晶体中不存在的作用力类型有________
硼酸晶体中不存在的作用力类型有________ 填字母
填字母 。
。
 范德华力
范德华力  氢键 c.
氢键 c. 键 d.
键 d. 键
键
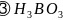 是一元弱酸,在水中电离方程式为
是一元弱酸,在水中电离方程式为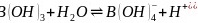 ,
,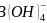 中B原子的杂化方式为________。
中B原子的杂化方式为________。
 根据对角线规则,B和________
根据对角线规则,B和________ 填元素符号
填元素符号 的性质相似。
的性质相似。
 某镁铝合金的晶胞为立方结构,其结构如图2所示,该晶体中Al原子的配位数为________。
某镁铝合金的晶胞为立方结构,其结构如图2所示,该晶体中Al原子的配位数为________。
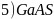 、GaN的结构均与金刚石相似,GaAs的熔点低于GaN的主要原因为________。
、GaN的结构均与金刚石相似,GaAs的熔点低于GaN的主要原因为________。
 砷化镓晶胞结构如图3所示。已知:砷化镓晶体密度为d
砷化镓晶胞结构如图3所示。已知:砷化镓晶体密度为d 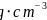 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为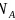 。
。
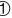 连接面心上6个砷原子构成正八面体,该正八面体的边长为________
连接面心上6个砷原子构成正八面体,该正八面体的边长为________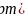 用含d和
用含d和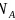 的代数式表示
的代数式表示 。
。
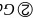 和As之间的最近距离为________
和As之间的最近距离为________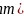 用含d和
用含d和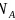 的代数式表示
的代数式表示 。
。
【化学
 选修3:物质结构与性质】
选修3:物质结构与性质】
教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
 图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有________种,其中原子序数最大的基态原子的外围电子排布式为________。
图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有________种,其中原子序数最大的基态原子的外围电子排布式为________。
 图一
图一
 图二中,每条折线代表周期表中
图二中,每条折线代表周期表中 某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为________;与x点对应的简单氢化物互为等电子体的离子为________
某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为________;与x点对应的简单氢化物互为等电子体的离子为________ 写一种
写一种 。
。
 图二
图二
 图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与
图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与 形成的化学键类型为________;5号C原子和6号C原子的杂化方式分别为________、________;该分子中所含非金属元素的电负性由小到大的顺序为________。
形成的化学键类型为________;5号C原子和6号C原子的杂化方式分别为________、________;该分子中所含非金属元素的电负性由小到大的顺序为________。
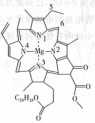 图三
图三
 从石墨晶体结构示意图中截取石墨的晶胞如图四所示,设阿伏加德罗常数为
从石墨晶体结构示意图中截取石墨的晶胞如图四所示,设阿伏加德罗常数为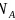 ,已知
,已知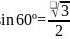 ,石墨晶体的密度为________
,石墨晶体的密度为________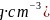 列出计算式
列出计算式 。
。
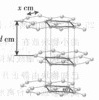 图四
图四
 化学
化学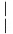 选修3:物质结构与性质
选修3:物质结构与性质
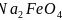 、
、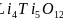 和
和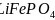 均可用作电极材料。请回答下列问题:
均可用作电极材料。请回答下列问题:
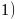 基态
基态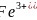 的价层电子轨道表达式为________________;同周期元素中,基态原子的未成对电子数与基态
的价层电子轨道表达式为________________;同周期元素中,基态原子的未成对电子数与基态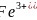 相同的元素为________。
相同的元素为________。
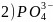 的空间构型为________________,其中P原子的杂化方式为________;写出一种与
的空间构型为________________,其中P原子的杂化方式为________;写出一种与 互为等电子体且中心原子与P不同主族的阴离子:________
互为等电子体且中心原子与P不同主族的阴离子:________ 填离子符号
填离子符号 。
。
 为紫色晶体,其中1mol阳离子中所含
为紫色晶体,其中1mol阳离子中所含 键的数目为________;配位键中提供孤电子对的原子为________
键的数目为________;配位键中提供孤电子对的原子为________ 填元素符号
填元素符号 。
。
 已知物质间的转化关系如图甲所示,其中a、c均大于0。
已知物质间的转化关系如图甲所示,其中a、c均大于0。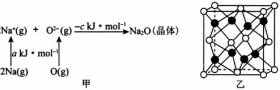
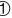 基态Na原子的第一电离能可表示为________。
基态Na原子的第一电离能可表示为________。
 相同条件下,
相同条件下,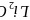 的晶格能________
的晶格能________ 填“
填“ ”“
”“ ”或“
”或“ ”
”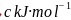 ,原因为________________________________________________________________________。
,原因为________________________________________________________________________。
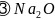 的立方晶胞结构如图乙所示。若紧邻的两个
的立方晶胞结构如图乙所示。若紧邻的两个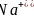 之间的距离为dpm,阿伏加德罗常数的值为
之间的距离为dpm,阿伏加德罗常数的值为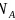 ,晶体的密度为
,晶体的密度为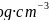 ,则Na的摩尔质量可表示为________________
,则Na的摩尔质量可表示为________________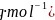 用含有d、
用含有d、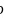 、
、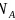 的代数式表示
的代数式表示 。
。
据报道,某科研团队成功合成了钛掺杂、镧镍锂氧化物包覆的“双重修饰”富镍三元正极材料。请回答下列问题:
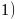 基态钛原子的外围电子排布图为____________。
基态钛原子的外围电子排布图为____________。
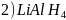 是一种还原剂,可将羧酸直接还原为醇:
是一种还原剂,可将羧酸直接还原为醇: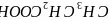
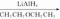
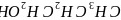 。
。
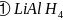 中存在的作用力类型有_____
中存在的作用力类型有_____ 填字母
填字母 。
。
 离子键
离子键 配位键
配位键 氢键
氢键 非极性键
非极性键
 乙醚
乙醚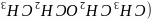 、乙醇的沸点分别为
、乙醇的沸点分别为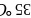 、
、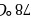 ,导致二者沸点差异的主要原因是___________________________。
,导致二者沸点差异的主要原因是___________________________。
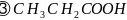 分子中C原子的杂化方式为_______;所含
分子中C原子的杂化方式为_______;所含 键和
键和 键的数目之比为_____;键角
键的数目之比为_____;键角 ____
____ 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
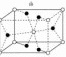
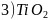 的晶胞结构如图甲所示,其中白球代表__
的晶胞结构如图甲所示,其中白球代表__ 填“Ti”或“O”
填“Ti”或“O” ,黑球的配位数为____。
,黑球的配位数为____。
 氧化镍的立方晶胞结构如图乙所示。已知氧化镍晶体的密度为
氧化镍的立方晶胞结构如图乙所示。已知氧化镍晶体的密度为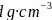 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。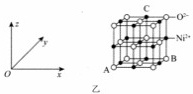
 坐标参数表示原子在晶体中的相对位置。已知A、B的坐标参数分别为
坐标参数表示原子在晶体中的相对位置。已知A、B的坐标参数分别为 0,
0,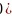 、
、 1,
1,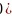 ,则C的坐标参数为_________。
,则C的坐标参数为_________。
 晶胞面心上的6个氧离子构成正八面体形,镍离子位于体心,该正八面体的边长为_____
晶胞面心上的6个氧离子构成正八面体形,镍离子位于体心,该正八面体的边长为_____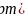 用含有d、
用含有d、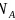 的代数式表示
的代数式表示 。
。
第四周期某些过渡元素在工业生产中有着极其重要的作用

 铬是最硬的金属单质,被称为“不锈钢的添加剂”
铬是最硬的金属单质,被称为“不锈钢的添加剂” 写出Cr在周期表中的位置________;其原子核外电子排布的最高能层符号________
写出Cr在周期表中的位置________;其原子核外电子排布的最高能层符号________
 在
在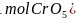 其中Cr为
其中Cr为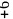 价
价 中,含有过氧键的数目为________
中,含有过氧键的数目为________
题目解答
答案
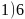 ;
;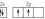 ;
; 平面三角形;
平面三角形;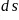 ;
;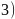 碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;
碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;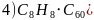 或
或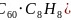 ;
;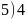 ;
;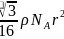 ;
;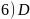 。
。【解析】【分析】本题是对物质结构与性质的考查,涉及核外电子排布、微粒结构与性质、晶胞结构与计算等,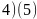 为易错点、难点,需要学生具备一定的数学计算能力和一定的空间想象。【解答】
为易错点、难点,需要学生具备一定的数学计算能力和一定的空间想象。【解答】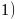 碳原子核外有6个电子,核外电子排布式为
碳原子核外有6个电子,核外电子排布式为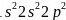 ,有1s、2s、
,有1s、2s、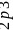 个能级,故核外有6种空间运动状态的电子,碳原子价电子排布式为
个能级,故核外有6种空间运动状态的电子,碳原子价电子排布式为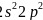 ,根据泡利原理与洪特规则,价电子排布图为
,根据泡利原理与洪特规则,价电子排布图为 ;故答案为:6;
;故答案为:6; ;
;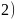 光气的分子式为
光气的分子式为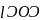 ,其分子中C原子形成3个
,其分子中C原子形成3个 键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取
键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取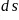 杂化;故答案为:平面三角形;
杂化;故答案为:平面三角形;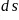 ;
;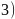 碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;故答案为:碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;
碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;故答案为:碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;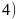 晶体结构中
晶体结构中 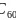 处于顶点与面心,立方烷分子填充在原
处于顶点与面心,立方烷分子填充在原 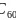 晶体分子的八面体空隙中,则立方烷处于晶体结构单元的体心和棱心位置,结构单元中有
晶体分子的八面体空隙中,则立方烷处于晶体结构单元的体心和棱心位置,结构单元中有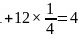 分子
分子 ,结构单元中
,结构单元中 数目为
数目为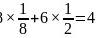 ,则化学式为
,则化学式为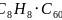 或
或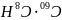 ;故答案为:
;故答案为: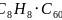 或
或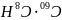 ;
;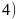 由图可知石墨的晶胞结构为
由图可知石墨的晶胞结构为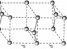 ,设晶胞的底边长为acm,晶胞的高为
,设晶胞的底边长为acm,晶胞的高为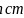 ,层间距为dcm,则
,层间距为dcm,则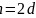 ,底面图为
,底面图为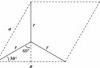 ,则
,则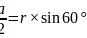 ,可得
,可得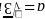 ,则底面面积为
,则底面面积为 ,晶胞中C原子数目为
,晶胞中C原子数目为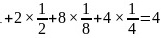 ,晶胞质量为
,晶胞质量为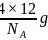 ,则:
,则: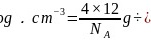 ,整理可得
,整理可得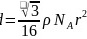 ;故答案为:4;
;故答案为:4;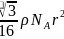 ;
;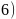 体对角线上的原子投影重合,投影在正六边形中心,另外6个顶点原子投影形成正六边形,面心上6个C原子投影也形成小的正六边形,图形D符合。故答案为:D。2.【答案】
体对角线上的原子投影重合,投影在正六边形中心,另外6个顶点原子投影形成正六边形,面心上6个C原子投影也形成小的正六边形,图形D符合。故答案为:D。2.【答案】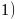
 ;纺锤形
;纺锤形 或哑铃形
或哑铃形 ;
;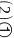 平面三角形;
平面三角形;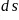 ;
; 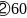 ;
;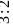 ;
;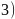 二十;原子;
二十;原子;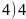 ;
;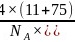 .
.
【解析】【分析】本题考查核外电子排布,杂化方式、空间构型以及晶胞的相关知识,试题具有一定的综合性,有利于考查学生分析问题和解决问题的能力,试题难度一般。【解答】 砷的价电子数为5,位于周期表的第四周期,因此其价电子排布图为
砷的价电子数为5,位于周期表的第四周期,因此其价电子排布图为 ,基态B原子核外电子占据最高能级为2p能级,因此电子云轮廓图为纺锤形
,基态B原子核外电子占据最高能级为2p能级,因此电子云轮廓图为纺锤形 或哑铃形
或哑铃形 ,故答案为:
,故答案为: ;纺锤形
;纺锤形 或哑铃形
或哑铃形 ;
;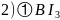 中硼原子形成的价电子对数为3,因此B原子的采取
中硼原子形成的价电子对数为3,因此B原子的采取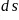 杂化,其空间构型为平面三角形,故答案为:平面三角形;
杂化,其空间构型为平面三角形,故答案为:平面三角形;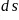 ;
; 根据
根据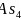 分子的空间结构分析可知其键角为60度,分子中成键电子对为6对,孤电子对为4对,二者的数目之比为
分子的空间结构分析可知其键角为60度,分子中成键电子对为6对,孤电子对为4对,二者的数目之比为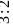 ,故答案为:60;
,故答案为:60;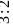 ;
;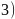 根据
根据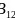 的结构分析可知每个面上平均有五分之三个B原子,因此其面数为
的结构分析可知每个面上平均有五分之三个B原子,因此其面数为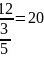 ,根据单质硼的熔点为
,根据单质硼的熔点为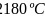 可知该晶体为原子晶体,故答案为:二十;原子;
可知该晶体为原子晶体,故答案为:二十;原子;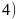 根据砷化硼的晶胞结构分析可知As原子的配位数为4,根据晶胞结构分析可知每个晶胞中含有4个B原子和4个As原子,因此晶胞的密度为
根据砷化硼的晶胞结构分析可知As原子的配位数为4,根据晶胞结构分析可知每个晶胞中含有4个B原子和4个As原子,因此晶胞的密度为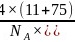 ,故答案为:4;
,故答案为:4;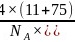 。3.【答案】
。3.【答案】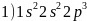 ;ⅥB;
;ⅥB;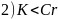 ;
;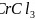 是分子晶体,
是分子晶体,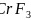 是离子晶体;
是离子晶体; 正四面体;
正四面体;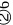 ;配位;
;配位;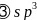 ;
;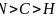 ;
;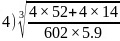 。
。
【解析】【分析】本题考查物质结构和性质,涉及了核外电子排布式、晶体类型、杂化轨道理论、配合物理论和晶胞的计算等,这些知识点都是学习重点、高考热点,难点是确定配晶体计算,应注意晶体中所含微粒数目。【解答】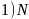 原子为7号元素,基态N原子的核外电子排布式为
原子为7号元素,基态N原子的核外电子排布式为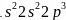 ;铬的原子序数为24,位于周期表第4周期ⅥB族;故答案为:
;铬的原子序数为24,位于周期表第4周期ⅥB族;故答案为: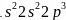 ;ⅥB;
;ⅥB; 同一周期元素,第一电力能从左往右呈增大趋势,所以Cr与K两种元素原子第一电离能的大小关系为
同一周期元素,第一电力能从左往右呈增大趋势,所以Cr与K两种元素原子第一电离能的大小关系为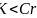 ;
;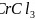 是分子晶体,
是分子晶体,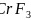 是离子晶体,所以两者的熔点相差较大,;故答案为:
是离子晶体,所以两者的熔点相差较大,;故答案为: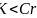 ;
;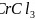 是分子晶体,
是分子晶体,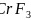 是离子晶体;
是离子晶体; 的中心原子Cl原子的电子对数
的中心原子Cl原子的电子对数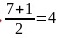 ,孤电子对数为0,所以阴离子
,孤电子对数为0,所以阴离子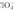 的空间构型为正四面体形;
的空间构型为正四面体形; 由图可知,配离子中,中心离子
由图可知,配离子中,中心离子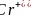 的配位数为6;N与中心原子形成的化学键称为配位键;故答案为:6;配位;
的配位数为6;N与中心原子形成的化学键称为配位键;故答案为:6;配位; 配体
配体 乙二胺
乙二胺 中碳原子的杂化方式是
中碳原子的杂化方式是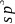 ;因为N原子的2p轨道处于半充满的状态,故分子中C、H、N、三种元素电负性从大到小的顺序为
;因为N原子的2p轨道处于半充满的状态,故分子中C、H、N、三种元素电负性从大到小的顺序为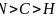 ;故答案为:
;故答案为: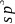 ;
;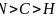 ;
;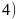 该晶胞中N原子的个数为:
该晶胞中N原子的个数为: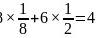 ,Cr原子的个数为:
,Cr原子的个数为: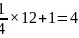 ;该晶胞的质量
;该晶胞的质量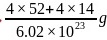 ,该晶胞的体积
,该晶胞的体积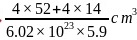 ,则氮化铬的晶胞边长
,则氮化铬的晶胞边长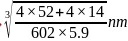 ;故答案为:
;故答案为: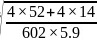 。4.【答案】
。4.【答案】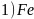 ;
; 、4;
、4;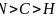 ;
;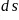 、
、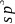 ;
;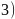 分子晶体;5;
分子晶体;5;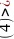 ;
;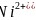 、
、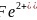 的电荷相同,
的电荷相同,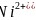 的离子半径小于
的离子半径小于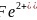 的离子半径,故晶格能:
的离子半径,故晶格能: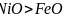 ,所以熔点
,所以熔点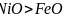 ;
; ;
;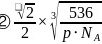
【解析】【分析】本题是对物质与性质的考查,涉及核外电子排布、配合物、电负性、杂化轨道、分子性质、晶格能、熔点高低比较、晶胞计算等,是对物质结构主干知识的综合考查,需要学生具备扎实的基础,掌握均摊法进行晶胞的有关计算。【解答】 铁、钴、镍的基态原子的价电子排布式分别为
铁、钴、镍的基态原子的价电子排布式分别为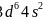 、
、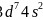 、
、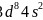 ,三种元素原子的核外未成对电子数分别为4、3、2,未成对电子数最多的是Fe;故答案为:Fe;
,三种元素原子的核外未成对电子数分别为4、3、2,未成对电子数最多的是Fe;故答案为:Fe; 有孤对电子的N原子与Co通过配位键结合,形成配位键后形成4对共用电子对,形成3对共用电子对的N原子形成普通的共价键,1号、3号N原子形成3对共用电子对,为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合;酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性
有孤对电子的N原子与Co通过配位键结合,形成配位键后形成4对共用电子对,形成3对共用电子对的N原子形成普通的共价键,1号、3号N原子形成3对共用电子对,为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合;酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性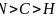 ;分子中N原子有形成3个
;分子中N原子有形成3个 键,含有1对孤对电子,有形成4个
键,含有1对孤对电子,有形成4个 键,没有孤对电子,杂化轨道数目为4,N原子的杂化轨道类型为
键,没有孤对电子,杂化轨道数目为4,N原子的杂化轨道类型为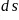 、
、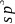 ;故答案为:2、4;
;故答案为:2、4;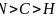 ;
;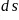 、
、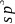 ;
;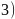 配合物
配合物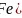 的熔沸点比较低,易溶于非极性溶剂,应属于分子晶体;Fe原子价电子数为8,CO提供一对孤对电子,与Fe原子形成配位键,则
的熔沸点比较低,易溶于非极性溶剂,应属于分子晶体;Fe原子价电子数为8,CO提供一对孤对电子,与Fe原子形成配位键,则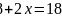 ,解得
,解得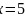 ;故答案为:分子晶体;5;
;故答案为:分子晶体;5;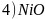 、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,
、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,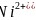 、
、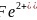 的电荷相同,
的电荷相同,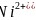 的离子半径小于
的离子半径小于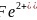 的离子半径,故晶格能:
的离子半径,故晶格能: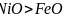 ,所以熔点
,所以熔点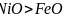 ;故答案为:
;故答案为: ;
;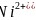 、
、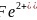 的电荷相同,
的电荷相同,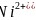 的离子半径小于
的离子半径小于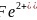 的离子半径,故晶格能:
的离子半径,故晶格能: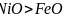 ,所以熔点
,所以熔点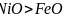 ;
; 晶胞中As原子数目为4,Ni原子数目
晶胞中As原子数目为4,Ni原子数目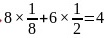 ,二者为1:1,由晶胞结构可知As原子配位数为4,故Ni的配位数为4;故答案为:4;
,二者为1:1,由晶胞结构可知As原子配位数为4,故Ni的配位数为4;故答案为:4; 面心与顶点上的Ni原子距离最近,最近的
面心与顶点上的Ni原子距离最近,最近的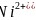 之间的距离为晶胞棱长的
之间的距离为晶胞棱长的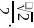 晶胞质量
晶胞质量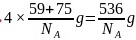 ,晶胞体积
,晶胞体积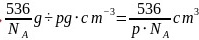 ,晶胞棱长
,晶胞棱长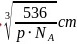 ,故最近的
,故最近的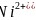 之间的距离
之间的距离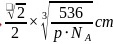 ,故答案为:
,故答案为: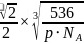 。5.【答案】
。5.【答案】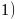

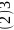 ;3
;3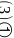 平面三角形
平面三角形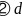
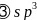
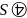
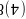
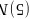 原子的半径小于As原子半径,
原子的半径小于As原子半径,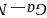 键的键长小于
键的键长小于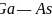 键,
键,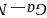 键的键能大于
键的键能大于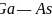 键
键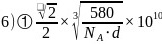
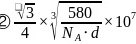
【解析】【分析】本题为物质结构题,掌握原子核外电子排布规律、杂化轨道理论、晶胞的计算是解题的关键,难度较大。【解答】 的原子序数为5,核外电子排布图为:
的原子序数为5,核外电子排布图为: ,故答案为:
,故答案为: ;
;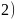 同周期从左到右第一电离能呈增大的趋势,但ⅡA族核外原子轨道全充满,ⅤA族元素p轨道半充满,第一电离能比相邻元素大,同周期元素中第一电离能处于B和N之间有Be、C、O三种元素,同周期从左到右,元素的电负性逐渐增大,第二周期电负性最大的元素为F,占据1s、2s、2p3个能级,故答案为:3;3;
同周期从左到右第一电离能呈增大的趋势,但ⅡA族核外原子轨道全充满,ⅤA族元素p轨道半充满,第一电离能比相邻元素大,同周期元素中第一电离能处于B和N之间有Be、C、O三种元素,同周期从左到右,元素的电负性逐渐增大,第二周期电负性最大的元素为F,占据1s、2s、2p3个能级,故答案为:3;3;
 由图示可知B与3个O氧原子相连,采取
由图示可知B与3个O氧原子相连,采取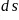 杂化,3个O原子构成平面三角形,故答案为:平面三角形;
杂化,3个O原子构成平面三角形,故答案为:平面三角形; 硼酸晶体中含有范德华力、氢键和
硼酸晶体中含有范德华力、氢键和 键,不含有
键,不含有 键,故答案为:d;
键,故答案为:d; 在
在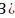 中B的杂化轨道数为4,采取
中B的杂化轨道数为4,采取 杂化,故答案为:
杂化,故答案为: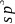 ;
; 根据对角线规则,B与右下角的Si的性质相似,故答案为:Si;
根据对角线规则,B与右下角的Si的性质相似,故答案为:Si; 由图可知Al的配位数为8,故答案为:8;
由图可知Al的配位数为8,故答案为:8; 原子的半径小于As原子半径,
原子的半径小于As原子半径,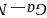 键的键长小于
键的键长小于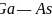 键,
键,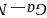 键的键能大于
键的键能大于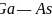 键,故GaAs的熔点低于GaN,故答案为:N原子的半径小于As原子半径,
键,故GaAs的熔点低于GaN,故答案为:N原子的半径小于As原子半径,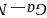 键的键长小于
键的键长小于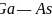 键,
键,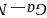 键的键能大于
键的键能大于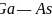 键;
键;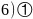 每个晶胞中含有Ga原子数为:4,As原子数:
每个晶胞中含有Ga原子数为:4,As原子数: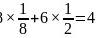 ,晶胞的质量
,晶胞的质量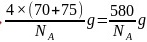 ,晶胞的边长
,晶胞的边长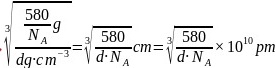 ,则6个As原子构成正八面体的边长
,则6个As原子构成正八面体的边长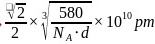 ,故答案为:
,故答案为: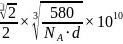 ;
; 和Ga之间的最近距离
和Ga之间的最近距离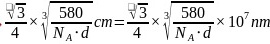 ,故答案为:
,故答案为: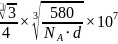 。6.【答案】
。6.【答案】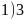 ;
;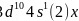 点对应的氢化物为
点对应的氢化物为 ,另外三条曲线中第二周期对应的气态氢化物分别为
,另外三条曲线中第二周期对应的气态氢化物分别为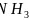 、
、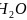 、HF,其分子间存在氢键,导致沸点反常升高;
、HF,其分子间存在氢键,导致沸点反常升高;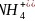 ;
; 配位键;
配位键;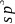
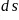 ;
;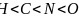 ;
;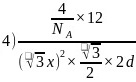 。
。
【解析】【分析】本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布等知识点,侧重考查学生分析计算及空间想象能力,难点是晶胞计算,题目难度中等。【解答】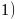 第四周期中,基态4s能级半充满的元素有K、Cr、Cu,共3种元素,其中原子序数最大为Cu,其基态原子的外围电子排布式为
第四周期中,基态4s能级半充满的元素有K、Cr、Cu,共3种元素,其中原子序数最大为Cu,其基态原子的外围电子排布式为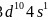 ,故答案为:3;
,故答案为:3; ;
;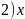 点对应的氢化物为
点对应的氢化物为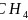 ,另外三条曲线中第二周期对应的气态氢化物分别为
,另外三条曲线中第二周期对应的气态氢化物分别为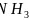 、
、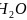 、HF,其分子间存在氢键,导致沸点反常升高;与
、HF,其分子间存在氢键,导致沸点反常升高;与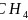 互为等电子体的离子为
互为等电子体的离子为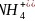 ,故答案为:x点对应的氢化物为
,故答案为:x点对应的氢化物为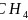 ,另外三条曲线中第二周期对应的气态氢化物分别为
,另外三条曲线中第二周期对应的气态氢化物分别为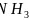 、
、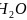 、HF,其分子间存在氢键,导致沸点反常升高;
、HF,其分子间存在氢键,导致沸点反常升高;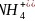 ;
;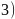 根据卟啉配合物叶绿素的结构示意图知,1号和3号N原子给
根据卟啉配合物叶绿素的结构示意图知,1号和3号N原子给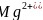 提供孤电子对形成配位键;5号C原子形成4个单键,6号C原子形成双键,其杂化方式分别为
提供孤电子对形成配位键;5号C原子形成4个单键,6号C原子形成双键,其杂化方式分别为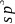 和
和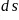 ;该分子中所含非金属元素电负性由小到大的顺序为
;该分子中所含非金属元素电负性由小到大的顺序为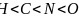 ,故答案为:配位键;
,故答案为:配位键;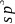
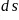 ;
;