题目
19.下列化学反应式中 () 的氧化剂和还原剂物质的量之比为3:2。-|||-A. ^4++(AS{O)_(3)}^3-+(H)_(2)Oarrow C(e)^3++(AS{O)_(4)}^3-+(H)^+ ()-|||-B. (Cr{O)_(2)}^-+(H)_(2)(O)_(2)+(OH)^-arrow (Cr{O)_(4)}^2-+(H)_(2)O-|||-C. (O)_(4)^-+(C)_(2)(O)_(4)^2-+(H)^+arrow (Mn)^2++C(O)_(2)+(H)_(2)O-|||-D. (Br{O)_(3)}^-+(I)^-+(H)^-arrow (Br)^-+(H)_(2)+(H)_(2)O ()

题目解答
答案
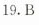
解析
本题考查氧化还原反应中氧化剂与还原剂的物质的量比的判断。解题核心在于:
- 确定各元素的氧化态变化,明确谁被氧化(还原剂)谁被还原(氧化剂);
- 根据电子守恒,建立氧化剂与还原剂的物质的量关系;
- 配平反应式(若未配平),验证比例是否符合题意。
选项B分析
反应式:${{Cr{O}_{2}}^{-}+{H}_{2}{O}_{2}+{OH}^{-}\rightarrow {{Cr{O}_{4}}^{2-}+{H}_{2}O}$
- 氧化态变化:
- $Cr$在$CrO_2^-$中为$+3$,在$CrO_4^{2-}$中为$+6$,被氧化,故$CrO_2^-$是还原剂;
- $O$在$H_2O_2$中为$-1$,在$H_2O$中为$-2$,被还原,故$H_2O_2$是氧化剂。
- 电子守恒:
- 每个$CrO_2^-$失去$3e^-$($+3 \to +6$),总失电子数为$3a$($a$为$CrO_2^-$物质的量);
- 每个$H_2O_2$分子获得$2e^-$($-1 \to -2$),总得电子数为$2b$($b$为$H_2O_2$物质的量);
- 由$3a = 2b$,得$\frac{a}{b} = \frac{2}{3}$,即还原剂与氧化剂的物质的量比为$2:3$;
- 题目要求氧化剂与还原剂的比为$3:2$,符合选项B。
其余选项排除
- 选项A:$Ce^{4+}$(氧化剂)与$AsO_3^{3-}$(还原剂)系数均为$1$,比为$1:1$;
- 选项C:$MnO_4^-$(氧化剂)与$C_2O_4^{2-}$(还原剂)比为$2:5$;
- 选项D:$BrO_3^-$(氧化剂)与$I^-$(还原剂)比为$1:6$。