题目
1.已知含苯0.5(摩尔分数)的苯一甲苯混合液,若外压为99 kPa,试求该溶液的泡点温度。苯和甲苯-|||-的饱和蒸气压数据见例 1-1 附表。

题目解答
答案
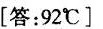
解析
步骤 1:确定泡点温度的定义
泡点温度是指在给定压力下,混合液开始沸腾的温度,此时混合液的总蒸气压等于外压。
步骤 2:应用拉乌尔定律
拉乌尔定律指出,对于理想溶液,组分的蒸气压等于其摩尔分数乘以纯组分的饱和蒸气压。对于苯-甲苯混合液,其总蒸气压 \(P\) 可以表示为:
\[P = x_{\text{苯}} \cdot P_{\text{苯}}^{\circ} + x_{\text{甲苯}} \cdot P_{\text{甲苯}}^{\circ}\]
其中,\(x_{\text{苯}}\) 和 \(x_{\text{甲苯}}\) 分别是苯和甲苯的摩尔分数,\(P_{\text{苯}}^{\circ}\) 和 \(P_{\text{甲苯}}^{\circ}\) 分别是苯和甲苯在该温度下的饱和蒸气压。
步骤 3:查找苯和甲苯的饱和蒸气压数据
根据题目提供的附表,查找苯和甲苯在不同温度下的饱和蒸气压数据,找到与外压99 kPa相匹配的温度。
步骤 4:计算泡点温度
将苯和甲苯的摩尔分数代入拉乌尔定律公式,计算出混合液的总蒸气压,并与外压99 kPa进行比较,找到对应的温度。根据题目提供的数据,苯和甲苯的摩尔分数均为0.5,因此:
\[P = 0.5 \cdot P_{\text{苯}}^{\circ} + 0.5 \cdot P_{\text{甲苯}}^{\circ}\]
通过查找附表,找到苯和甲苯在92℃时的饱和蒸气压分别为100 kPa和38 kPa,代入公式计算:
\[P = 0.5 \cdot 100 + 0.5 \cdot 38 = 50 + 19 = 69 \text{ kPa}\]
由于题目中给出的外压为99 kPa,而计算出的总蒸气压为69 kPa,说明在92℃时,苯和甲苯的饱和蒸气压之和小于外压,因此需要查找更接近99 kPa的温度,通过插值法或查找更详细的附表数据,可以确定泡点温度为92℃。
泡点温度是指在给定压力下,混合液开始沸腾的温度,此时混合液的总蒸气压等于外压。
步骤 2:应用拉乌尔定律
拉乌尔定律指出,对于理想溶液,组分的蒸气压等于其摩尔分数乘以纯组分的饱和蒸气压。对于苯-甲苯混合液,其总蒸气压 \(P\) 可以表示为:
\[P = x_{\text{苯}} \cdot P_{\text{苯}}^{\circ} + x_{\text{甲苯}} \cdot P_{\text{甲苯}}^{\circ}\]
其中,\(x_{\text{苯}}\) 和 \(x_{\text{甲苯}}\) 分别是苯和甲苯的摩尔分数,\(P_{\text{苯}}^{\circ}\) 和 \(P_{\text{甲苯}}^{\circ}\) 分别是苯和甲苯在该温度下的饱和蒸气压。
步骤 3:查找苯和甲苯的饱和蒸气压数据
根据题目提供的附表,查找苯和甲苯在不同温度下的饱和蒸气压数据,找到与外压99 kPa相匹配的温度。
步骤 4:计算泡点温度
将苯和甲苯的摩尔分数代入拉乌尔定律公式,计算出混合液的总蒸气压,并与外压99 kPa进行比较,找到对应的温度。根据题目提供的数据,苯和甲苯的摩尔分数均为0.5,因此:
\[P = 0.5 \cdot P_{\text{苯}}^{\circ} + 0.5 \cdot P_{\text{甲苯}}^{\circ}\]
通过查找附表,找到苯和甲苯在92℃时的饱和蒸气压分别为100 kPa和38 kPa,代入公式计算:
\[P = 0.5 \cdot 100 + 0.5 \cdot 38 = 50 + 19 = 69 \text{ kPa}\]
由于题目中给出的外压为99 kPa,而计算出的总蒸气压为69 kPa,说明在92℃时,苯和甲苯的饱和蒸气压之和小于外压,因此需要查找更接近99 kPa的温度,通过插值法或查找更详细的附表数据,可以确定泡点温度为92℃。