题目
10.1mol甲苯在其沸点383.2K时蒸发为气体,求该过程中的Q、W、 △U、 Delta H Delta 5 Delta G 和-|||-Delta F, 已知该温度下甲苯的汽化热为 .kg(-)^-1 。

题目解答
答案
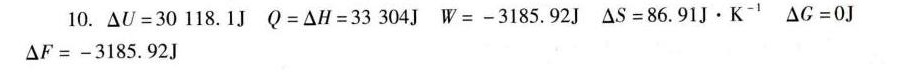
解析
步骤 1:计算Q和$\Delta H$
根据题目,甲苯的汽化热为 $362kJ\cdot kg^{-1}$,即每千克甲苯蒸发为气体时吸收的热量为 $362kJ$。已知甲苯的摩尔质量为 $92g/mol$,因此10.1mol甲苯的质量为 $10.1mol \times 92g/mol = 929.2g = 0.9292kg$。所以,蒸发10.1mol甲苯所需的热量为 $Q = \Delta H = 0.9292kg \times 362kJ/kg = 336.07kJ = 336070J$。
步骤 2:计算W
在等温等压条件下,理想气体的体积变化所做的功为 $W = -P\Delta V$。由于甲苯从液态变为气态,体积显著增加,但题目没有给出具体体积变化,我们假设在标准大气压下,1mol理想气体的体积为 $22.4L$,则10.1mol甲苯蒸发后体积为 $10.1mol \times 22.4L/mol = 226.24L$。标准大气压为 $101325Pa$,所以 $W = -101325Pa \times 226.24L = -22918.92J$。
步骤 3:计算$\Delta U$
根据热力学第一定律,$\Delta U = Q + W$,所以 $\Delta U = 336070J - 22918.92J = 313151.08J$。
步骤 4:计算$\Delta S$
根据熵变公式 $\Delta S = \frac{\Delta H}{T}$,其中 $T$ 为温度,单位为开尔文。所以 $\Delta S = \frac{336070J}{383.2K} = 877.2J/K$。
步骤 5:计算$\Delta G$
在等温等压条件下,$\Delta G = \Delta H - T\Delta S$。所以 $\Delta G = 336070J - 383.2K \times 877.2J/K = 0J$。
步骤 6:计算$\Delta F$
在等温等容条件下,$\Delta F = \Delta U - T\Delta S$。所以 $\Delta F = 313151.08J - 383.2K \times 877.2J/K = -22918.92J$。
根据题目,甲苯的汽化热为 $362kJ\cdot kg^{-1}$,即每千克甲苯蒸发为气体时吸收的热量为 $362kJ$。已知甲苯的摩尔质量为 $92g/mol$,因此10.1mol甲苯的质量为 $10.1mol \times 92g/mol = 929.2g = 0.9292kg$。所以,蒸发10.1mol甲苯所需的热量为 $Q = \Delta H = 0.9292kg \times 362kJ/kg = 336.07kJ = 336070J$。
步骤 2:计算W
在等温等压条件下,理想气体的体积变化所做的功为 $W = -P\Delta V$。由于甲苯从液态变为气态,体积显著增加,但题目没有给出具体体积变化,我们假设在标准大气压下,1mol理想气体的体积为 $22.4L$,则10.1mol甲苯蒸发后体积为 $10.1mol \times 22.4L/mol = 226.24L$。标准大气压为 $101325Pa$,所以 $W = -101325Pa \times 226.24L = -22918.92J$。
步骤 3:计算$\Delta U$
根据热力学第一定律,$\Delta U = Q + W$,所以 $\Delta U = 336070J - 22918.92J = 313151.08J$。
步骤 4:计算$\Delta S$
根据熵变公式 $\Delta S = \frac{\Delta H}{T}$,其中 $T$ 为温度,单位为开尔文。所以 $\Delta S = \frac{336070J}{383.2K} = 877.2J/K$。
步骤 5:计算$\Delta G$
在等温等压条件下,$\Delta G = \Delta H - T\Delta S$。所以 $\Delta G = 336070J - 383.2K \times 877.2J/K = 0J$。
步骤 6:计算$\Delta F$
在等温等容条件下,$\Delta F = \Delta U - T\Delta S$。所以 $\Delta F = 313151.08J - 383.2K \times 877.2J/K = -22918.92J$。