题目
电导率是衡量物质导电能力大小的物理量。将NaOH稀溶液滴加到稀盐酸过程中电导率曲线如图所示。下列说法不正确的是( )电导率-|||-a-|||-b-|||-d-|||-。-|||-c-|||-0 V(NaOH溶液) A.b点反应的离子方程式为H^++OH^-=H_(2)OB.把NaOH稀溶液换成NaOH固体,电导率曲线不变C.溶液的酸性:a gt b gt c gt dD.c点溶液呈中性
电导率是衡量物质导电能力大小的物理量。将$NaOH$稀溶液滴加到稀盐酸过程中电导率曲线如图所示。下列说法不正确的是( )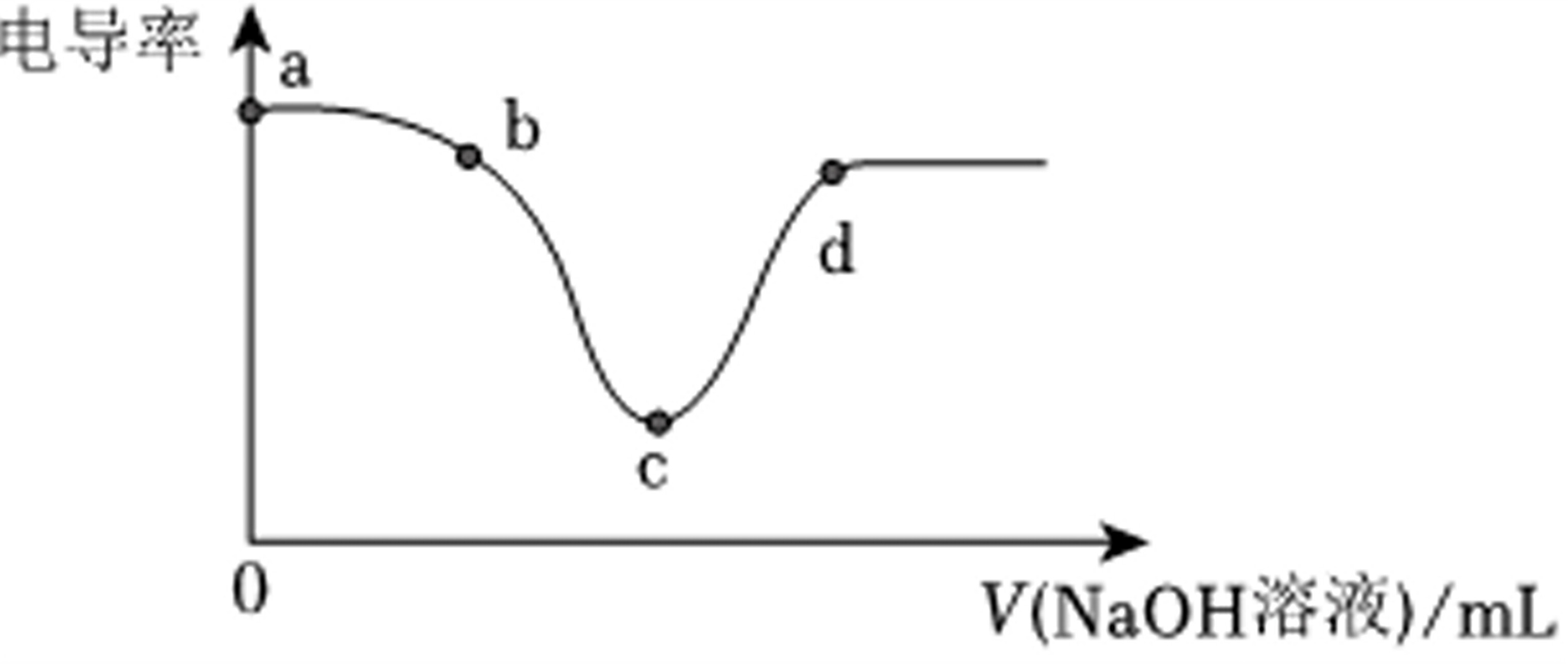
A.$b$点反应的离子方程式为$H^{+}+OH^{-}=H_{2}O$
B.把$NaOH$稀溶液换成$NaOH$固体,电导率曲线不变
C.溶液的酸性:$a \gt b \gt c \gt d$
D.$c$点溶液呈中性

A.$b$点反应的离子方程式为$H^{+}+OH^{-}=H_{2}O$
B.把$NaOH$稀溶液换成$NaOH$固体,电导率曲线不变
C.溶液的酸性:$a \gt b \gt c \gt d$
D.$c$点溶液呈中性
题目解答
答案
$A.a$、$b$、$c$点对应的离子方程式相同,都是$H^{+}+OH^{-}=H_{2}O$,故$A$正确;
$B$.把$NaOH$稀溶液换成$ NaOH $固体,反应后溶液体积不会有质的变化,导电离子浓度不会有太大改变,反应生成的水与原体积相比,也不会导致离子浓度急剧下降,所以电导率曲线不会与加$NaOH$稀溶液一样,故$B$错误;
$C$.随着$ NaOH $的加入,盐酸被反应,酸性减弱,到$c $点溶液刚好被完全反应,呈中性,所溶液的酸性:$a \gt b \gt c \gt d$,故$C$正确;
$D.c $点$NaOH $和盐酸刚好被完全反应,溶液呈中性,故$D$正确;
故选:$B$。
$B$.把$NaOH$稀溶液换成$ NaOH $固体,反应后溶液体积不会有质的变化,导电离子浓度不会有太大改变,反应生成的水与原体积相比,也不会导致离子浓度急剧下降,所以电导率曲线不会与加$NaOH$稀溶液一样,故$B$错误;
$C$.随着$ NaOH $的加入,盐酸被反应,酸性减弱,到$c $点溶液刚好被完全反应,呈中性,所溶液的酸性:$a \gt b \gt c \gt d$,故$C$正确;
$D.c $点$NaOH $和盐酸刚好被完全反应,溶液呈中性,故$D$正确;
故选:$B$。