题目
5g/50g×100%=65% (1分) 39.2g/80g×100%=49%(1分)答:黄铜屑样品中的锌的质量分数为65%,所用稀硫酸中溶质的质量分数为49%。(1分)(3)(共1分,得分点:起点、折点、曲线趋势等,错一处即不得分)山东省东营市26.鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80 g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半。试计算(计算结果保留1位小数):m(g) A-|||-95 A-|||-B-|||-90.6(1)产生CO2的质量为__________ g;(2)该鸡蛋壳中CaCO3的质量分数。(3)所用稀盐酸中溶质的质量分数。26.(10分)⑴ 4.4 …………………………………………………(2分)⑵设CaCO3质量为x,设参加反应的HCl质量为yCaCO3+2HCl=CaCl2+H2O+CO2↑100 73 44x y 4.4 gm(g) A-|||-95 A-|||-B-|||-90.6 …………(2分)m(g) A-|||-95 A-|||-B-|||-90.6 …………(2分)⑶m(g) A-|||-95 A-|||-B-|||-90.6 …………(2分)m(g) A-|||-95 A-|||-B-|||-90.6 …………(2分)苏州市26.(3分)(本题在a、b两小题,考生任选一题解答,不得两题都解。若两题都解,则以a小题计分)a.根据氢氧化钙的溶解度曲线,完成下列问题。m(g) A-|||-95 A-|||-B-|||-90.6(1)曲线上满足A点指标的溶液在升高温度后会产生的现象是: ▲ ,此时的溶液中溶质质量分数将 ▲ (选填“变大”或“变小”或“不变”)(2)若向曲线上满足A点指标的溶液中加入生石灰,则溶液中的溶质质量奖 ▲ (选填“增加”或“减少”或“不变”)b.根据氯化钠的溶解度曲线,完成下列问题。m(g) A-|||-95 A-|||-B-|||-90.6(1)A点所示溶液为某温度下氯化钠的 ▲ (选填“饱和”或“不饱和”)溶液。(2)将B点所示的溶液升高温度到40℃(忽略水的蒸发),此时溶液中溶质质量分数将 ▲ (选填“变大”或“变小”或“不变”)。(3)B点代表20 ℃时氯化钠的溶解度为36.0g,若将满足B点指标的溶液恒温蒸发10g水,会有 ▲ g氯化钠晶体折出。27.(5分)某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:实验序号样品的质量/g滤渣的质量/g第一次3.40.3第二次3.60.4第三次5.00.5(1)该样品中碳酸钙质量分数的平均值为: ▲ (结果精确到0.1%)。(2)引起三次实验数据差异的操作原因可能是: ▲ 。(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)26.(3分)a.(1)出现浑浊 变小 (2)减少 (每空1分)b.(1)不饱和 (2)不变 (3)3.6 (每空l分)27.(5分)(1)90.0 % (1分)(2)石灰石中磷酸钙分布不均匀(或滤渣未清洗干净或称量样品不准确或称量滤渣不准确或石灰石颗粒未充分反应)(1分)(3)解:设生成氧化钙的质量为x。(方程式、列式、结果正确,但表达不规范给2分)CaCO3m(g) A-|||-95 A-|||-B-|||-90.6CaO+CO2↑ (1分)100 56100t×90.0% x (1分)x=50.4t (1分)答:理论上最多能得到氧化钙50.4t。烟台市30.(6分)2008年下半年发生的毒奶粉事件,是不法分子在牛奶或奶粉中添加了有毒的三聚氰胺造成的。三聚氰胺化学式为C3H6N6,是一种重要的化工原料。(1)三聚氰胺的相对分子质量为 ,碳、氢、氮三种元素的质量比为 ,氮元素的质量分数为 。(2)检测食品中蛋白质含量的传统方法是:通过检测食品中氮元素的含量,推算其蛋白质含量。例如,若检测到牛奶中的氮元素质量分数≥0.46%,即为蛋白质含量检测合格。某种不合格牛奶中氮元素的质量分数为0.36%,若向1000g该牛奶中加入2g三聚氰胺,请计算此时牛奶中氮元素的质量分数,并根据计算结果说明不法分子在牛奶中添加三聚氰胺的目的。31.(6分)小青在实验室发现一瓶长期敞口放置的浓盐酸,为方便以后使用,他对其浓度进行了测定。取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下:加入氢氧化钠的体积/mL1.08.09.510.512.016.5烧杯中溶液的pH1.01.32.03.99.911.912.8(1)请你绘制出烧杯中溶液的pH与加人氢氧化钠溶液体积(V)之间的变化关系图。m(g) A-|||-95 A-|||-B-|||-90.6(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数。(氢氧化钠溶液的密度按1.0g/mL计算)30.(6分)(1)126 6∶1∶14 66.7%(每空1分)(2)加入三聚氰胺后牛奶中氮元素的质量为m(g) A-|||-95 A-|||-B-|||-90.6 目的是提高牛奶中含氮量,造成牛奶中蛋白质含量高或合格的假象………………(1分)31.(6分)(1)(2分)评分要点:描点正确,曲线平滑。m(g) A-|||-95 A-|||-B-|||-90.6m(g) A-|||-95 A-|||-B-|||-90.6 (2)解:由上图可知,恰好完全反应时消耗氢氧化钠溶液的体积约为10.0mL(9.7mL~10.3mL之间取值均可)……………………………………………………………………(1分)答:此瓶盐酸的溶质质量分数是3.65%。漳州市23.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。试计算:(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?(2)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?(反应的化学方程式为Zn +H2SO4===ZnSO4 + H2↑)23. (1)解:设加水后溶液的质量为x10g ×98%= x×19.6%x =50g需要水的质量=50g一l0g =40g(2)解:设生成氢气的质量为xZn+H2SO4=ZnSO4 + H2↑98 220g ×19. 6% xm(g) A-|||-95 A-|||-B-|||-90.6 x =0. 08g答:略。贵港市21.酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用。小强同学在做中和反应实验时,向盛有40g10%的氢氧化钠溶液的烧杯中逐滴加入稀盐酸,当恰好完全反应时,共滴加了36.5g稀盐酸。(1)配置40g10%的氢氧化钠溶液需要水_________mL。(ρ水=1.0g/mL)(2)求:所加稀盐酸的溶质质量分数和反应后所得溶液中溶质的质量。(写出计算过程)
5g/50g×100%=65% (1分) 39.2g/80g×100%=49%(1分)
答:黄铜屑样品中的锌的质量分数为65%,所用稀硫酸中溶质的质量分数为49%。(1分)
(3)(共1分,得分点:起点、折点、曲线趋势等,错一处即不得分)
山东省东营市
26.鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80 g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半。试计算(计算结果保留1位小数):
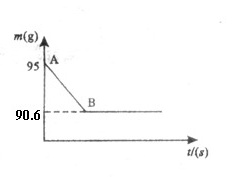 (1)产生CO2的质量为__________ g;
(1)产生CO2的质量为__________ g;(2)该鸡蛋壳中CaCO3的质量分数。
(3)所用稀盐酸中溶质的质量分数。
26.(10分)⑴ 4.4 …………………………………………………(2分)
⑵设CaCO3质量为x,设参加反应的HCl质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 4.4 g
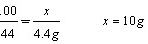 …………(2分)
…………(2分)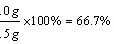 …………(2分)
…………(2分)⑶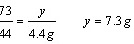 …………(2分)
…………(2分)
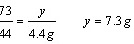 …………(2分)
…………(2分)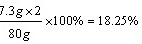 …………(2分)
…………(2分)苏州市
26.(3分)(本题在a、b两小题,考生任选一题解答,不得两题都解。若两题都解,则以a小题计分)
a.根据氢氧化钙的溶解度曲线,完成下列问题。
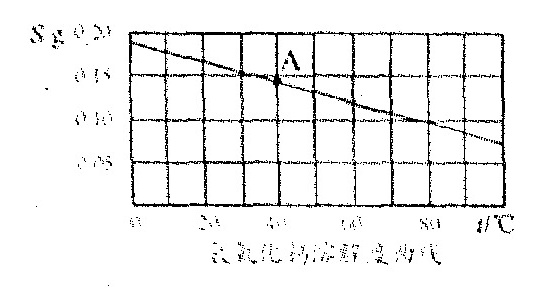 (1)曲线上满足A点指标的溶液在升高温度后会产生的现象是: ▲ ,此时的溶液中溶质质量分数将 ▲ (选填“变大”或“变小”或“不变”)
(1)曲线上满足A点指标的溶液在升高温度后会产生的现象是: ▲ ,此时的溶液中溶质质量分数将 ▲ (选填“变大”或“变小”或“不变”)(2)若向曲线上满足A点指标的溶液中加入生石灰,则溶液中的溶质质量奖 ▲ (选填“增加”或“减少”或“不变”)
b.根据氯化钠的溶解度曲线,完成下列问题。
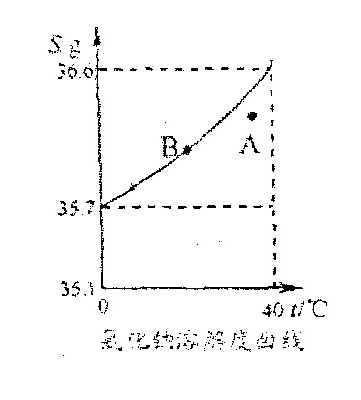 (1)A点所示溶液为某温度下氯化钠的 ▲ (选填“饱和”或“不饱和”)溶液。
(1)A点所示溶液为某温度下氯化钠的 ▲ (选填“饱和”或“不饱和”)溶液。(2)将B点所示的溶液升高温度到40℃(忽略水的蒸发),此时溶液中溶质质量分数将 ▲ (选填“变大”或“变小”或“不变”)。
(3)B点代表20 ℃时氯化钠的溶解度为36.0g,若将满足B点指标的溶液恒温蒸发10g水,会有 ▲ g氯化钠晶体折出。
27.(5分)某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:
实验序号 | 样品的质量/g | 滤渣的质量/g |
第一次 | 3.4 | 0.3 |
第二次 | 3.6 | 0.4 |
第三次 | 5.0 | 0.5 |
(1)该样品中碳酸钙质量分数的平均值为: ▲ (结果精确到0.1%)。
(2)引起三次实验数据差异的操作原因可能是: ▲ 。
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
26.(3分)
a.(1)出现浑浊 变小 (2)减少 (每空1分)
b.(1)不饱和 (2)不变 (3)3.6 (每空l分)
27.(5分)
(1)90.0 % (1分)
(2)石灰石中磷酸钙分布不均匀(或滤渣未清洗干净或称量样品不准确或称量滤渣不准确或石灰石颗粒未充分反应)(1分)
(3)解:设生成氧化钙的质量为x。(方程式、列式、结果正确,但表达不规范给2分)
CaCO3 CaO+CO2↑ (1分)
CaO+CO2↑ (1分)
 CaO+CO2↑ (1分)
CaO+CO2↑ (1分)100 56
100t×90.0% x (1分)
x=50.4t (1分)
答:理论上最多能得到氧化钙50.4t。
烟台市
30.(6分)2008年下半年发生的毒奶粉事件,是不法分子在牛奶或奶粉中添加了有毒的三聚氰胺造成的。三聚氰胺化学式为C3H6N6,是一种重要的化工原料。
(1)三聚氰胺的相对分子质量为 ,碳、氢、氮三种元素的质量比为 ,
氮元素的质量分数为 。
(2)检测食品中蛋白质含量的传统方法是:通过检测食品中氮元素的含量,推算其蛋白质含量。例如,若检测到牛奶中的氮元素质量分数≥0.46%,即为蛋白质含量检测合格。某种不合格牛奶中氮元素的质量分数为0.36%,若向1000g该牛奶中加入2g三聚氰胺,请计算此时牛奶中氮元素的质量分数,并根据计算结果说明不法分子在牛奶中添加三聚氰胺的目的。
31.(6分)小青在实验室发现一瓶长期敞口放置的浓盐酸,为方便以后使用,他对其浓度进行了测定。取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下:
加入氢氧化钠的体积/mL | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 | |
烧杯中溶液的pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
(1)请你绘制出烧杯中溶液的pH与加人氢氧化钠溶液体积(V)之间的变化关系图。
(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数。(氢氧化钠溶液的密度按1.0g/mL计算)
30.(6分)(1)126 6∶1∶14 66.7%(每空1分)
(2)加入三聚氰胺后牛奶中氮元素的质量为
 目的是提高牛奶中含氮量,造成牛奶中蛋白质含量高或合格的假象………………(1分)
目的是提高牛奶中含氮量,造成牛奶中蛋白质含量高或合格的假象………………(1分)31.(6分)
(1)(2分)评分要点:描点正确,曲线平滑。
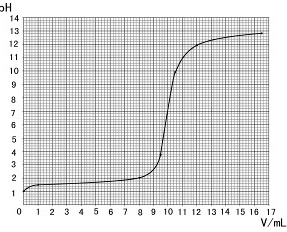
 (2)解:由上图可知,恰好完全反应时消耗氢氧化钠溶液的体积约为10.0mL(9.7mL~10.3mL之间取值均可)……………………………………………………………………(1分)
(2)解:由上图可知,恰好完全反应时消耗氢氧化钠溶液的体积约为10.0mL(9.7mL~10.3mL之间取值均可)……………………………………………………………………(1分)答:此瓶盐酸的溶质质量分数是3.65%。
漳州市
23.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实
验室现有的是溶质质量分数为98%的浓硫酸。试计算:
(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?
(2)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?(反应的化学方程式为Zn +H2SO4===ZnSO4 + H2↑)
23. (1)解:设加水后溶液的质量为x
10g ×98%= x×19.6%
x =50g
需要水的质量=50g一l0g =40g
(2)解:设生成氢气的质量为x
Zn+H2SO4=ZnSO4 + H2↑
98 2
20g ×19. 6% x
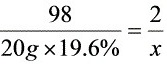 x =0. 08g
x =0. 08g答:略。
贵港市
21.酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用。小强同学在做中和反应实验时,向盛有40g10%的氢氧化钠溶液的烧杯中逐滴加入稀盐酸,当恰好完全反应时,共滴加了36.5g稀盐酸。
(1)配置40g10%的氢氧化钠溶液需要水_________mL。(ρ水=1.0g/mL)
(2)求:所加稀盐酸的溶质质量分数和反应后所得溶液中溶质的质量。(写出计算过程)
题目解答
答案
[解答] (1)12×3+1×6+14×6==126
⑵C∶O∶N==36∶6∶84==6∶1∶14
⑶三聚氰胺中氮元素的质量分数==84/126==66.7%
49.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量。
[解答] 解:设生成0.2g氢气,需锌的质量为X
Zn + 2HCl ==ZnCl2 + H2↑
65 2
X 0.2g
65/X==2/0.2g X==6.5g
铜的质量==20g-6.5g==13.5g 答:铜的质量为13.5g
45.用“侯氏制碱法”制得的纯碱常含有少量的氯化钠。将10g含有氯化钠的纯碱溶解于102.32g稀盐酸中,恰好完全反应,收集到3.52g的气体(假设生成的气体全部逸出)。
求:反应后得到的不饱和溶液中溶质的质量分数。
45.解:设该纯碱样品中碳酸钠的质量为x,生成的氯化钠的质量为y,则( 0.5分 )
Na2CO3 +2 HCl = 2NaCl + H2O + CO2↑ (1分 )
106 117 44
x y 3.52g
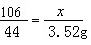
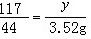
x=8.48g ( 1 分 ) y=9.36g( 1 分 )
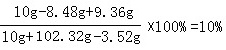 ( 1 分 )
( 1 分 )答:反应后得到的不饱和溶液中溶质的质量分数为10% ( 0.5分 )
说明:其它合理解法参照本标准酌情给分。
山东省德城区
7、(5分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如下图所示。
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
 (2)水垢中碳酸钙的质量分数是多少?
(2)水垢中碳酸钙的质量分数是多少?(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解12.5 g水垢,至少需要质量分数为10%的盐酸的质量是 (最后结果保留一位小数)。
7.解:
(1)3.3····································1分
(2)设12.5g水垢中碳酸钙的质量为x
CaCO3+ 2HCl==CaCl2+H2O+CO2↑···················· 1分
100 44
x 3.3g
x =100×3.3g÷44=7.5g························· 1分
7.5 g
水垢中碳酸钙的质量分数为:──────×100%=60%··············1分
12.5 g
(3)117.7 g···································1分
兰州市
39.(6分)2008年9月份曝光的引起国人共愤的“结石宝宝”事件,与婴幼儿服用含有三聚氰胺的奶粉有关。已知三聚氰胺为白色晶体,将它用作食品添加剂可提高食品中蛋白质的检测值,俗称“蛋白精”, 化学式为C3H6N6。据此请计算:
(1)三聚氰胺中各元素的质量比 ;
25.(7分)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5 g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收。测得吸收氨气的溶液总质量m与反应时间t的变化如右下图所示。所涉及的反应为:
(NH4)2SO4+2NaOH===Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4 == (NH4)2SO4 。
请计算:
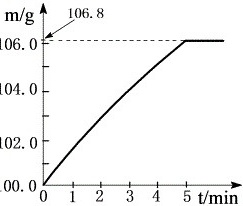 (1)完全反应后产生氨气 g。
(1)完全反应后产生氨气 g。(2)该化肥的含氮量为 (精确到0.1%),
则这种化肥属于 (填:“合格”或“不合格”。
合格硫酸铵含氮量为20%以上)产品。
(3)请计算废硫酸中硫酸的质量分数(写出计算
过程)。
(4)若实验过程中氨气被完全吸收,但该实验测得硫酸铵化肥的含氮量高于实际值,其原因是 。
24.(5分)
(1)(2分)微量(1分) 72 : 11(1分)
(2)(1分) 0.05%
(3)(2分)1
25.(7分)
(1)(1分)6.8g
(2)(2分)20.4% 合格
(3)解:设废硫酸中纯硫酸的质量为x 。
2NH3 + H2SO4 == (NH4)2SO4,