题目
某兴趣小组的同学向一定体积的 rm Ba((OH))_(2) 溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如右图所示。A-|||-C-|||-B.-|||-o a-|||-时间(1)写出rm Ba((OH))_(2) 溶液与稀硫酸反应的离子方程式。(2)该小组的同学关于右图的下列说法中,正确的是_____(填序号)。①AB段溶液的导电能力不断减弱,说明生成的rm Ba(SO)_(4) 不是电解质②B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子③BC段溶液的导电能力不断增大,主要是由于过量的rm Ba((OH))_(2) 电离出的离子导电④a时刻rm Ba((OH))_(2) 溶液与稀硫酸恰好完全中和
某兴趣小组的同学向一定体积的 $$\rm Ba{(OH)}_{2} $$溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如右图所示。
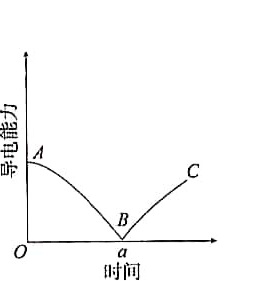
(1)写出$$\rm Ba{(OH)}_{2} $$溶液与稀硫酸反应的离子方程式。
(2)该小组的同学关于右图的下列说法中,正确的是_____(填序号)。
①AB段溶液的导电能力不断减弱,说明生成的$$\rm Ba{SO}_{4} $$不是电解质
②B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
③BC段溶液的导电能力不断增大,主要是由于过量的$$\rm Ba{(OH)}_{2} $$电离出的离子导电
④a时刻$$\rm Ba{(OH)}_{2} $$溶液与稀硫酸恰好完全中和
题目解答
答案
(1)$$\rm {Ba}^{2+}+2{OH}^{-} +2{H}^{+}+{SO}_{4}^{2-} \!=\!=\!= Ba{SO}_{4} \downarrow + 2{H}_{2} O$$
(2)②④
解析
考查要点:
- 离子方程式的书写:需明确强酸、强碱的电离形式,以及反应中生成沉淀和水的过程。
- 溶液导电性与离子浓度的关系:理解导电能力变化与离子浓度、电解质性质的关系,结合化学反应的进程分析图像。
解题核心思路:
- 离子方程式:强酸与强碱反应时,需拆分强电解质,保留弱电解质或沉淀的化学式。
- 图像分析:导电能力变化反映离子浓度变化,结合反应终点(恰好中和)和过量试剂的影响判断各阶段导电性变化的原因。
破题关键点:
- BaSO₄的性质:虽难溶但属于强电解质,溶解部分完全电离。
- 恰好中和的判断:导电能力最低点对应反应完全,此时溶液中离子浓度最低。
第(1)题
关键步骤:
- 拆分强电解质:Ba(OH)₂和H₂SO₄均完全电离为离子形式。
- 反应过程:H⁺与OH⁻结合生成H₂O,Ba²⁺与SO₄²⁻结合生成BaSO₄沉淀。
- 书写离子方程式:
$\rm Ba^{2+} + 2OH^- + 2H^+ + SO_4^{2-} \rightarrow BaSO_4 \downarrow + 2H_2O$
第(2)题
选项分析:
- ①错误:BaSO₄是强电解质,导电能力减弱是因离子浓度降低,而非BaSO₄的非电解质性质。
- ②正确:B点导电能力接近0,说明溶液中几乎无自由离子(反应完全,生成沉淀和水)。
- ③错误:BC段导电性恢复是因过量的H⁺和SO₄²⁻(来自硫酸)导电,而非Ba(OH)₂。
- ④正确:a时刻对应导电能力最低点,说明Ba(OH)₂与硫酸恰好完全中和。