在25℃时,将水中的一切杂质除去,水的电导率将是多少?25℃时水的离子积 _(W)=-|||-_({H)^+}(C)_({OH)^-}=1.008times (10)^-14 。下列各电解质的极限当量电导分别为: (lambda )_(0)(KOH)=274.4S(cm)^2/eq ,-|||-(lambda )_(0)(HCl)=426.04 (Scm)^2/eg, (lambda )_(0)(KCl)=149.82 (Scm)^2/eq

题目解答
答案
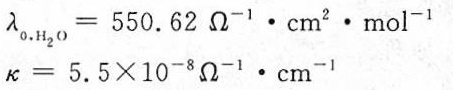
解析
考查要点:本题主要考查纯水电导率的计算,涉及水的离子积、极限当量电导率的拆分与应用,以及单位换算。
解题核心思路:
- 确定导电离子:纯水中唯一导电离子为$H^+$和$OH^-$,其浓度由水的离子积$K_W$确定。
- 拆分极限当量电导率:利用KOH、HCl、KCl的极限当量电导率,拆分出$H^+$和$OH^-$的极限当量电导率之和。
- 计算总电导率:将离子浓度与对应的极限当量电导率相乘并求和。
破题关键点:
- 单位换算:需将浓度从mol/L转换为mol/cm³。
- 极限当量电导率的拆分:通过联立方程求解$H^+$和$OH^-$的极限当量电导率之和。
1. 拆分极限当量电导率
设$λ_0(K^+)$、$λ_0(H^+)$、$λ_0(Cl^-)$、$λ_0(OH^-)$分别为离子的极限当量电导率,根据题目数据:
$\begin{cases}λ_0(K^+) + λ_0(OH^-) = 274.4 \quad \text{(KOH)} \\λ_0(H^+) + λ_0(Cl^-) = 426.04 \quad \text{(HCl)} \\λ_0(K^+) + λ_0(Cl^-) = 149.82 \quad \text{(KCl)}\end{cases}$
联立方程:
- 用第3式减第2式:$λ_0(K^+) - λ_0(H^+) = -276.22$
- 代入第1式:$λ_0(H^+) + λ_0(OH^-) = 550.62$
结论:$H^+$和$OH^-$的极限当量电导率之和为$550.62 \, \text{S·cm}^2/\text{mol}$。
2. 计算离子浓度
纯水中$[H^+] = [OH^-] = \sqrt{K_W} = \sqrt{1.008 \times 10^{-14}} \approx 1.004 \times 10^{-7} \, \text{mol/L}$。
单位换算:
$1.004 \times 10^{-7} \, \text{mol/L} = 1.004 \times 10^{-10} \, \text{mol/cm}^3$
3. 计算总电导率
总电导率公式为:
$k = (λ_0(H^+) + λ_0(OH^-)) \cdot c = 550.62 \cdot 1.004 \times 10^{-10} \approx 5.5 \times 10^{-8} \, \Omega^{-1} \cdot \text{cm}^{-1}$