(24分)(2015春•新疆校级期中)元素周期表前四周期A、B、C、D、E五种元素.A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子.(1)写出元素名称:C 氧 、D 磷 、E 锰 .(2)C基态原子的电子排布图为 dfrac (+41)(15)-|||-11 ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 σ键 键(填“σ”或“π”).(3)当n=2时,B的最简单气态氢化物的电子式为 dfrac (+41)(15)-|||-11 ,BC2分子的结构式是 O=C=O ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 SiO2+2OH﹣═SiO32﹣+H2O .(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是 O>P>Si>Li (用元素符号表示).(5)E元素原子的特征电子构型是 3d54s2 ,在元素周期表中位置是 第四周期ⅦB族 ,其最高价氧化物的化学式是 Mn2O7 .考点:位置结构性质的相互关系应用.版权所有专题:元素周期律与元素周期表专题.分析:短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,原子序数为25,则E为Mn元素,(1)根据分析选出B、C、D元素的名称;(2)C为氧元素,氧原子核外电子总数为8,含有2个电子层,据此画出其基态原子电子排布图;A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;(3)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;BC2分子为二氧化碳,CO2为直线型结构,分子中存在两个碳氧双键,根据其电子式写出其结构式;当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,写出二氧化硅与氢氧化钠溶液反应的离子方程式;(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大;(5)Mn元素的3d轨道处于半满状态,据此写出其特征电子构型;根据Mn元素的原子序数判断其在周期表中位置;锰元素的总共正价为+7价,据此写出其最高价氧化物的化学式.解答:解:短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,E为Mn元素,(1)根据分析可知,C为氧元素、D为磷元素、E为锰元素,故答案为:氧;磷;锰;(2)C为O元素,氧元素核电荷数为8,核外电子总数为8,氧原子基态原子电子排布图为:;若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,故答案为:;σ键;(3)当n=2时,BC元素,其简单氢化物为CH4,甲烷为共价化合物,分子中存在4个碳氢键,其电子式为:;BC2为CO2,二氧化碳分子中含有两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O;当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH﹣═SiO32﹣+H2O,故答案为:;O=C=O;SiO2+2OH﹣═SiO32﹣+H2O;(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,故答案为:O>P>Si>Li;(5)E为Mn元素,Mn元素的3d轨道含有5个电子,处于半满状态,Mn元素原子的特征电子构型为:3d54s2,锰元素的原子序数为25,核外含有4个电子层,位于周期表中第四周期ⅦB族,Mn的最高化合价为+7价,其最高价氧化物的化学式为:Mn2O7,故答案为:3d54s2;第四周期ⅦB族;Mn2O7.点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见元素的原子结构与元素周期表、元素周期律的关系,明确常见化学用语的概念及书写原则..
(24分)(2015春•新疆校级期中)元素周期表前四周期A、B、C、D、E五种元素.A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子.
(1)写出元素名称:C 氧 、D 磷 、E 锰 .
(2)C基态原子的电子排布图为 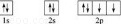 ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 σ键 键(填“σ”或“π”).
,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 σ键 键(填“σ”或“π”).
(3)当n=2时,B的最简单气态氢化物的电子式为 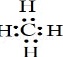 ,BC2分子的结构式是 O=C=O ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 SiO2+2OH﹣═SiO32﹣+H2O .
,BC2分子的结构式是 O=C=O ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 SiO2+2OH﹣═SiO32﹣+H2O .
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是 O>P>Si>Li (用元素符号表示).
(5)E元素原子的特征电子构型是 3d54s2 ,在元素周期表中位置是 第四周期ⅦB族 ,其最高价氧化物的化学式是 Mn2O7 .
考点:
位置结构性质的相互关系应用.版权所有
专题:
元素周期律与元素周期表专题.
分析:
短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,原子序数为25,则E为Mn元素,
(1)根据分析选出B、C、D元素的名称;
(2)C为氧元素,氧原子核外电子总数为8,含有2个电子层,据此画出其基态原子电子排布图;A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;
(3)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构;BC2分子为二氧化碳,CO2为直线型结构,分子中存在两个碳氧双键,根据其电子式写出其结构式;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,写出二氧化硅与氢氧化钠溶液反应的离子方程式;
(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大;
(5)Mn元素的3d轨道处于半满状态,据此写出其特征电子构型;根据Mn元素的原子序数判断其在周期表中位置;锰元素的总共正价为+7价,据此写出其最高价氧化物的化学式.
解答:
解:短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,E为Mn元素,
(1)根据分析可知,C为氧元素、D为磷元素、E为锰元素,
故答案为:氧;磷;锰;
(2)C为O元素,氧元素核电荷数为8,核外电子总数为8,氧原子基态原子电子排布图为:;
若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为:;σ键;
(3)当n=2时,BC元素,其简单氢化物为CH4,甲烷为共价化合物,分子中存在4个碳氢键,其电子式为:;
BC2为CO2,二氧化碳分子中含有两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH﹣═SiO32﹣+H2O,
故答案为:;O=C=O;SiO2+2OH﹣═SiO32﹣+H2O;
(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,
故答案为:O>P>Si>Li;
(5)E为Mn元素,Mn元素的3d轨道含有5个电子,处于半满状态,Mn元素原子的特征电子构型为:3d54s2,锰元素的原子序数为25,核外含有4个电子层,位于周期表中第四周期ⅦB族,Mn的最高化合价为+7价,其最高价氧化物的化学式为:Mn2O7,
故答案为:3d54s2;第四周期ⅦB族;Mn2O7.
点评:
本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见元素的原子结构与元素周期表、元素周期律的关系,明确常见化学用语的概念及书写原则.
.题目解答
答案
解答:
解:短周期元素A、B、C、D、E,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p层与s层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的M电子层的P层中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素;E元素有5个未成对电子,则E的电子排布式为:1s22s22p63s23p64s23d5,E为Mn元素,
(1)根据分析可知,C为氧元素、D为磷元素、E为锰元素,
故答案为:氧;磷;锰;
(2)C为O元素,氧元素核电荷数为8,核外电子总数为8,氧原子基态原子电子排布图为:;
若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为:;σ键;
(3)当n=2时,BC元素,其简单氢化物为CH4,甲烷为共价化合物,分子中存在4个碳氢键,其电子式为:;
BC2为CO2,二氧化碳分子中含有两个碳氧双键,为直线型结构,二氧化碳的结构式为:O=C=O;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH﹣═SiO32﹣+H2O,
故答案为:;O=C=O;SiO2+2OH﹣═SiO32﹣+H2O;
(4)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,
故答案为:O>P>Si>Li;
(5)E为Mn元素,Mn元素的3d轨道含有5个电子,处于半满状态,Mn元素原子的特征电子构型为:3d54s2,锰元素的原子序数为25,核外含有4个电子层,位于周期表中第四周期ⅦB族,Mn的最高化合价为+7价,其最高价氧化物的化学式为:Mn2O7,
故答案为:3d54s2;第四周期ⅦB族;Mn2O7.
点评:
本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见元素的原子结构与元素周期表、元素周期律的关系,明确常见化学用语的概念及书写原则.
.