题目
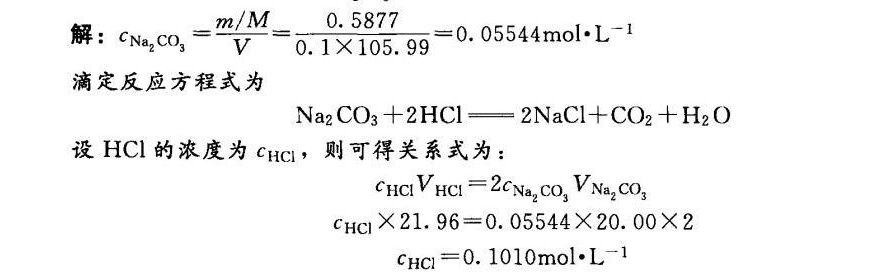
[例 4-6】 准确称取0.5877g基准试剂Na2 CO3,在100mL容量瓶中配制成溶液,其浓-|||-度为多少?称取该标准溶液20.00mL标定某HCl溶液,滴定中用去HCl溶液21.96mL,-|||-计算该HCl溶液的浓度。( _({Na)_(2)C(O)_(3)}=105.99gcdot (001)^-1 )

题目解答
答案
解析
步骤 1:计算Na2CO3溶液的浓度
首先,根据给定的Na2CO3的质量和摩尔质量,计算Na2CO3的摩尔数。然后,利用摩尔数和溶液体积计算Na2CO3溶液的浓度。
步骤 2:写出滴定反应方程式
Na2CO3与HCl反应的化学方程式为:${Na}_{2}C{O}_{3}+2HCl=2NaCl+C{O}_{2}+{H}_{2}O$。根据方程式,可以确定Na2CO3与HCl的摩尔比为1:2。
步骤 3:计算HCl溶液的浓度
根据Na2CO3溶液的浓度和体积,以及滴定中用去的HCl溶液体积,利用摩尔比关系计算HCl溶液的浓度。
首先,根据给定的Na2CO3的质量和摩尔质量,计算Na2CO3的摩尔数。然后,利用摩尔数和溶液体积计算Na2CO3溶液的浓度。
步骤 2:写出滴定反应方程式
Na2CO3与HCl反应的化学方程式为:${Na}_{2}C{O}_{3}+2HCl=2NaCl+C{O}_{2}+{H}_{2}O$。根据方程式,可以确定Na2CO3与HCl的摩尔比为1:2。
步骤 3:计算HCl溶液的浓度
根据Na2CO3溶液的浓度和体积,以及滴定中用去的HCl溶液体积,利用摩尔比关系计算HCl溶液的浓度。