题目
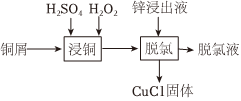
某工厂利用铜屑脱除锌浸出液中的Cl-并制备Zn,流程如下。“脱氯”步骤仅Cu元素化合价发生改变。下列说法正确的是( )H2SO4H2O2 锌浸出液-|||-铜屑 浸铜 脱氯|脱氯液-|||-CuCl固体锌浸出液中相关成分(其他成分无干扰) 离子 Zn2+ Cu2+ Cl- 浓度(g•L-1) 145 0.03 1 A. “浸铜”时应加入足量H2O2,确保铜屑溶解完全B. “浸铜”反应:2Cu+4H++H2O2═2Cu2++H2↑+2H2OC. “脱氯”反应:Cu+Cu2++2Cl-═2CuClD. 脱氯液净化后电解,可在阳极得到Zn
某工厂利用铜屑脱除锌浸出液中的Cl-并制备Zn,流程如下。“脱氯”步骤仅Cu元素化合价发生改变。下列说法正确的是( )
锌浸出液中相关成分(其他成分无干扰)

锌浸出液中相关成分(其他成分无干扰)
| 离子 | Zn2+ | Cu2+ | Cl- |
| 浓度(g•L-1) | 145 | 0.03 | 1 |
- A. “浸铜”时应加入足量H2O2,确保铜屑溶解完全
- B. “浸铜”反应:2Cu+4H++H2O2═2Cu2++H2↑+2H2O
- C. “脱氯”反应:Cu+Cu2++2Cl-═2CuCl
- D. 脱氯液净化后电解,可在阳极得到Zn
题目解答
答案
解:A.“浸铜”时不能加入足量H2O2,否则铜屑溶解完全,不能发生后续的脱氯反应,故A错误;
B.“浸铜”反应无氢气产生,发生反应:Cu+2H++H2O2═Cu2++2H2O,故B错误;
C.“脱氯”反应:Cu+Cu2++2Cl-═2CuCl,故C正确;
D.脱氯液净化后电解,阴极上产生Zn,故D错误;
故选:C。
B.“浸铜”反应无氢气产生,发生反应:Cu+2H++H2O2═Cu2++2H2O,故B错误;
C.“脱氯”反应:Cu+Cu2++2Cl-═2CuCl,故C正确;
D.脱氯液净化后电解,阴极上产生Zn,故D错误;
故选:C。
解析
步骤 1:分析“浸铜”步骤
“浸铜”步骤中,铜屑在酸性条件下与过氧化氢反应,生成铜离子和水。根据题目信息,铜屑溶解完全,但不能加入过量的过氧化氢,否则会破坏后续的“脱氯”步骤。因此,选项A错误。
步骤 2:分析“浸铜”反应方程式
“浸铜”反应方程式为:Cu + 2H^{+} + H_2O_2 → Cu^{2+} + 2H_2O。反应中没有氢气产生,因此选项B错误。
步骤 3:分析“脱氯”步骤
“脱氯”步骤中,铜离子和氯离子反应生成CuCl固体,同时铜元素的化合价发生变化。反应方程式为:Cu + Cu^{2+} + 2Cl^{-} → 2CuCl。因此,选项C正确。
步骤 4:分析脱氯液电解
脱氯液净化后电解,阴极上产生Zn,而不是阳极。因此,选项D错误。
“浸铜”步骤中,铜屑在酸性条件下与过氧化氢反应,生成铜离子和水。根据题目信息,铜屑溶解完全,但不能加入过量的过氧化氢,否则会破坏后续的“脱氯”步骤。因此,选项A错误。
步骤 2:分析“浸铜”反应方程式
“浸铜”反应方程式为:Cu + 2H^{+} + H_2O_2 → Cu^{2+} + 2H_2O。反应中没有氢气产生,因此选项B错误。
步骤 3:分析“脱氯”步骤
“脱氯”步骤中,铜离子和氯离子反应生成CuCl固体,同时铜元素的化合价发生变化。反应方程式为:Cu + Cu^{2+} + 2Cl^{-} → 2CuCl。因此,选项C正确。
步骤 4:分析脱氯液电解
脱氯液净化后电解,阴极上产生Zn,而不是阳极。因此,选项D错误。