螇电化学部分练习题袆(Ⅰ)电质溶液膀?一、选择题罿1.用同一电导池分别测定浓度为0.01mol·kg和0.1mol·kg的两个电质溶液,膈其电阻分别为1000和500,则它们依次的摩尔电导率之比为()芄(A)1:5(B)5:1芃(C)10:5(D)5:10罿2.298K时,0.005mol·kg-1的KCl和0.005mol·kg-1的NaAc溶液的离子平均活芅度系数分别为,和,,则有()肅(A),=,(B),>,羂(C),<,(D),≥,聿3.在HAc离常数测定的实验中,总是应用惠斯顿电桥。作为电桥平衡点的指零仪器,结合本实验,不能选用的是: ()蚅(A) 耳机 (B) 电导率仪蒃 (C) 阴极射线示波器 (D) 直流桥流计螀4.1-1型电质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于:()腿(A)强电质 (B)?弱电质肆(C)无限稀释电质溶液 (D)摩尔浓度为1的溶液膅二、填空题螃1.CaCl摩尔电导率与其离子的摩尔电导率的关系是:____艿?_________________________。蒇2. 0.3mol·kgNaHPO水溶液的离子强度是____0.9________mol·kg。蚃3.浓度为0.1mol·kg的MgCl1水溶液,其离子强度为__0.3_________________mol·kg。薂4.有下列溶液:荿(A)0.001mol·kgKCl(B)0.001mol·kgKOH羈(C)0.001mol·kgHCl(D)1.0mol·kgKCl莅其中摩尔电导率最大的是();最小的是()。莁?三、计算题蒈125℃时,浓度为0.01,mol·dm的BaCl水溶液的电导率为0.2382,,而该电质中的钡离子的迁移数t(Ba)是0.4375,计算钡离子和氯离子的电迁移率U(Ba)和U(Cl)。肅2.25℃时,KCl和NaNO溶液的无限稀释摩尔电导率及离子的无限稀释迁移数如下:袃/(S·m·mol)t,肀KCl1.4985×100.4906薈NaNO1.2159×100.4124蒆计算:(1)氯化钠溶液的无限稀释摩尔电导率(NaCl)薅(2)氯化钠溶液中Na的无限稀释迁移数t(Na)和无限稀释淌度U(Na)。膃参考答案薈一、选择题袇1.(B)2.(A)3.(D) 4.(C)羃二、填空题袂1 2. 0.9 ?蚈3. 0.3 4.(C)(D)芈三、计算题蚄1[答] (3分)蚁2[答](NaCl)=(Na)+(Cl)螈=t(NaNO-1)+t(KCl)虿=1.2647×10S·m·mol膂t=(Na)/(NaCl)=0.3965蚃U=(Na)/F=5.200×10 m·s·V袈(Ⅱ)可逆电池的电动势及其应用螅一、选择题袄5.常用的甘汞电极的电极反应Hg-1Cl-1(s)+2e2Hg(l)+2Cl(aq)蒂设饱和甘汞电极、摩尔甘汞电极和0.1mol·dm甘汞电极的电极电势相应地为羈、、,则298K时,三者之相对大小是:()膆(A)>>(B)<<薆(C)>>(D)>=芁2.有下列两个浓差电池(a<a):肈(1)Cu(s)│Cu-3(a2)‖Cu2+(a2+)│Cu(s)薇(2)Pt│Cu(a),Cu(a')‖Cu(a),Cu(a')│Pt肄它们的电池反应与电动势E3和E之间的关系为:()羀(A)电池反应相同,E=E(B)电池反应不同,E=E膇(C)电池反应相同,E2=2E-1(D)电池反应相同,E=2E+羈3.Ag棒插入AgNO溶液中,Zn棒插入ZnCl溶液中,用盐桥联成电池,其自发电池的螆书面表示式为:()A. B. 肃Ag(s)|AgNO3(m1)||ZnCl2(m2)|Zn(s) C. D. 膇?Zn(s)|ZnCl2(m2)||AgNO3(m1)|Ag(s) E. F. 膅Ag(s)|AgNO3(m1)|ZnCl2(m2)|Zn(s) G. (H) 芄AgNO3(m1)|Ag(s)||Zn(s)|ZnCl2(m2)值的正或负可以用来说明:()电池是否可逆(电池反应是否已达平衡电池反应自发进行的方向(电池反应的限度羆二、填空题Zn,Zn)=-0.763V,2+(Fe,Fe)=-0.440V。这两电极排成自发电2+=________V,当有2mol电子的电量输出时,电池反应的K=________。Hg2+SO2+4→Hg2-SO2(s)设计成电池的表示式为:____________________________________________________________________。H4(g)+PbSO2(s)→Pb(s)+H4SO2(aq)设计成电池的表示式为:___________________________________________________________________。H4(a+)→H1(a+)设计成电池的表示式为:___________________________________________。肅三、计算题K时,有下列电池:Pt,Cl2(p2)|HCl(0.1mol·kg)|AgCl(s)|Ag(s),试求:螈(1)电池的电动势;薃(2)电动势温度系数和有1mol电子电量可逆输出时的热效应;gCl(s)的分压。H-1f(AgCl)=-1.2703×10mJ·mol,Ag(s),AgCl(s)和Cl5(g)的规定熵值S-12分别为:J·Km·mol。K,将金属银Ag插在碱溶液中,在通常的空气中银是否会被氧化?羀(空气中氧气分压为0.21p-1)试设计合适的电池进行判断。如果在溶液中加入大N-1,情况又怎样?已知:[Ag(CN)]-+e2─→Ag(s)+2CN-,-=-0.31VO-,OH)=0.401V,(Ag2O,Ag)=0.344V羃四、问答题肀在25℃时,利用下述反应设计电池,怎样才能使该可逆电池的电动势变为零?H-(g,101.325kPa)+Cu[a(Cu2)]─→2H2(a)+Cu(s)u2+/Cu的标准电极电位为0.337V。螂参考答案膀一、选择题=2+-RT/F×lna(l+)2.(4.(蒁二、填空题[答]E2+=0.323VK=8.46×10-[答]Hg(l)|HgSO(s)|SO102(aq)||Hg44(a)|Hg(l)[答]Pt,H2-(g)|H2SO2+(aq)|PbSO2(s)|Pb(s)[答]Pt,H2(p4)|H4(a2)||H(a+)|H2(p+),Pt莀三、计算题[答]电池反应为:gCl(s)→Ag(s)+Clr(pr)芃⑴=-1.105VQ2=T-S22=2.042×10J螄 ⑶; ; [答]│O(0.21p2+)│Ptg(s)+(1/2)O(0.21p2)─→Ag2O(s)=Ee-RT/2×ln(1/a(O15 ))-2O-1,OH16 )--2(Ag-1O,Ag)-0.05915/2×lg1/(0.21)7 V>0电池为自发的,表明Ag在OH-2溶液中会被氧化,加入CN-1g(CN),Ag)=-0.31V<2+(AgO,Ag),这时负极发生Agg(CN)的反应,而不是生成Ag2O的反应。蚀四、问答题[答]H+(g,101.325kPa)│HCl(a阴)‖CuSO(a2+)│Cu(s)=E2+-RT/2×ln[a阳(H)/a(Cu2)]u2/Cu)-0.05916/2lg[a2(H+)/a(Cu2)]HCl而言:a=(阳)阴(m/m2)+,若取a2=a2,2+=1+)2+=(m/m2+)+uSO2+而言:a=(-)14(m/m),若取a=a,=1=m/m=(Cu/Cu)-0.02958lg[(m(HCl))/m(CuSO)]=0必须满足HCl))/m(CuSO)=2.48×10罿(Ⅲ)电与极化膈一、选择题芄1.极谱分中加入大量惰性电质的目的是:()增加溶液电导(固定离子强度消除迁移电流(上述几种都是K、0.1mol·dm的HCl溶液中,氢电极的热力学电势为-0.06V,电此溶液肅时,氢在铜电极上的出电势为:()大于-0.06V(等于-0.06V小于-0.06V(不能判定H在锌上的超电势为0.7V,(Zn/Zn)=-0.763V,电一含有Zn(a=0.01)的溶液,为了不使H出,溶液的pH值至少应控制在()pH>2.06(pH>2.72pH>7.10(pH>8.02e,Ca,Zn,Cu的电质溶液,已知e/Fe)=-0.440V,(Ca/Ca)=-2.866VZn/Zn)=-0.7628V,(Cu/Cu)=0.337V艿当不考虑超电势时,在电极上金属出的次序是:()Cu→Fe→Zn→CaCa→Zn→Fe→CuCa→Fe→Zn→CuCa→Cu→Zn→Fe羈二、填空题________;在金属的电化学腐蚀过程中,极________。蒈2.电工业中,为了衡量一个产品的经济指标,需要计算电能效率,它的表达式是________________________________________。Pt│H,H,(2)Pt│Fe,Fe,和(3)Pb│H,H的交换电流密度j分别为:(1)0.79mA·cm;(2)2.5mA·cm;(3)5.0×10A·cm。当它们在298K处于平衡态时,每秒有多少电子或质子通过双电层被输送?_____________cm·s;(2)_____________cm·s;(3)_____________cm·s。e/Fe)=-0.440V,(Cu/Cu)=0.337V,在25℃,p时,Pt为阴极,石墨为阳极,电含有FeCl(0.01mol·kg)和CuCl薅(0.02mol·kg)的水溶液,若电过程不断搅拌溶液,且超电势可忽略不计,则最______。薈三、计算题uCl溶液进行电,·cm,(1)问:在阴极上首先出什么物质?已知在电流密度为·cm时,氢在铜电极上的超电势为0.584V。V。假定氯气在石墨电极上的超电势可忽略不计。已知:u/Cu)=0.337V,(Cl/Cl)=1.36V,(O/HO,OH)=0.401V。Pt做电极电SnCl水溶液,在阴极上因H有超电势故只出Sn(s),在阳极O,已知=0.10,=0.010,氧在阳极上出的超电势为0.500V,Sn/Sn)=-0.140V,(O/HO)=1.23V。莄(1)写出电极反应,计算实际分电压V,试问要使降至何值时,才开始葿出氢气?薄四、问答题薁释理论分电压和实际分电压,并简要说明其不一致的原因薀参考答案膈一、选择题2.(C)4.(A)莂二、填空题羇1.增加;减少螃2.电能效率=莃3.[答]电子的电流密度是j/e,因每个电子携带电量大小为e,则:螆(1)4.94×10cm·s袃(2)1.56×10cm·s螄(3)3.12×10cm·se/Fe)=+RT/2F×ln0.01=-0.4992Vu/Cu)=+RT/2F×ln0.02=0.2868Vu袁三、计算题(共6题60分)[答]阴极:(Cu/Cu)=(Cu/Cu)+(RT/F)ln(Cu)=0.308V.H/H)=(H/H)+(RT/F)ln(H)-(H)=-0.998Vul/Cl)=(Cl/Cl)-(RT/F)ln(Cl)=1.40VO/HO,OH)=(O/HO,OH)-(RT/F)ln(OH)+(O)=1.71Vl[答](1)阴极:Sn+2e──→Sn(s)HO-2e──→O(g)+2HSn/Sn)+(RT/2F)ln(Sn)=-0.170VO)+(RT/2F)ln(H)+(O)=1.612V(分)=-=1.78VH出时H/H)-(H)=(Sn/Sn)H)=0.01+[0.1-(Sn)]×2(Sn)《(H)薇=0.21Sn)=2.9×10艿四、问答题[答]理论分电压------可逆电时的分电压,在数值上等于可逆电池的电动势.蚇实际分电压------实际电时的最小分电压,在数值上等于电流-电压曲线蚁上直线部分外延到电流为零处的电压。I≠0时,电极有极化
螇电化学部分练习题
袆(Ⅰ)电质溶液
膀?一、选择题
罿1.用同一电导池分别测定浓度为0.01mol·kg和0.1mol·kg的两个电质溶液,
膈其电阻分别为1000和500,则它们依次的摩尔电导率之比为()
芄(A)1:5(B)5:1
芃(C)10:5(D)5:10
罿2.298K时,0.005mol·kg-1的KCl和0.005mol·kg-1的NaAc溶液的离子平均活
芅度系数分别为,和,,则有()
肅(A),=,(B),>,
羂(C),<,(D),≥,
聿3.在HAc离常数测定的实验中,总是应用惠斯顿电桥。作为电桥平衡点的指零仪器,结合本实验,不能选用的是: ()
蚅(A) 耳机 (B) 电导率仪
蒃 (C) 阴极射线示波器 (D) 直流桥流计
螀4.1-1型电质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于:()
腿(A)强电质 (B)?弱电质
肆(C)无限稀释电质溶液 (D)摩尔浓度为1的溶液
膅二、填空题
螃1.CaCl摩尔电导率与其离子的摩尔电导率的关系是:____
艿?_________________________。
蒇2. 0.3mol·kgNaHPO水溶液的离子强度是____0.9________mol·kg。
蚃3.浓度为0.1mol·kg的MgCl1水溶液,其离子强度为__0.3_________________mol·kg。
薂4.有下列溶液:
荿(A)0.001mol·kgKCl(B)0.001mol·kgKOH
羈(C)0.001mol·kgHCl(D)1.0mol·kgKCl
莅其中摩尔电导率最大的是();最小的是()。
莁?三、计算题
蒈125℃时,浓度为0.01,mol·dm的BaCl水溶液的电导率为0.2382,,而该电质中的钡离子的迁移数t(Ba)是0.4375,计算钡离子和氯离子的电迁移率U(Ba)和U(Cl)。
肅2.25℃时,KCl和NaNO溶液的无限稀释摩尔电导率及离子的无限稀释迁移数如下:
袃/(S·m·mol)t,
肀KCl1.4985×100.4906
薈NaNO1.2159×100.4124
蒆计算:(1)氯化钠溶液的无限稀释摩尔电导率(NaCl)
薅(2)氯化钠溶液中Na的无限稀释迁移数t(Na)和无限稀释淌度U(Na)。
膃参考答案
薈一、选择题
袇1.(B)2.(A)3.(D) 4.(C)
羃二、填空题
袂1 2. 0.9 ?
蚈3. 0.3 4.(C)(D)
芈三、计算题
蚄1[答] (3分)
蚁2[答](NaCl)=(Na)+(Cl)
螈=t(NaNO-1)+t(KCl)
虿=1.2647×10S·m·mol
膂t=(Na)/(NaCl)=0.3965
蚃U=(Na)/F=5.200×10 m·s·V
袈(Ⅱ)可逆电池的电动势及其应用
螅一、选择题
袄5.常用的甘汞电极的电极反应Hg-1Cl-1(s)+2e2Hg(l)+2Cl(aq)
蒂设饱和甘汞电极、摩尔甘汞电极和0.1mol·dm甘汞电极的电极电势相应地为
羈、、,则298K时,三者之相对大小是:()
膆(A)>>(B)<<
薆(C)>>(D)>=
芁2.有下列两个浓差电池(a<a):
肈(1)Cu(s)│Cu-3(a2)‖Cu2+(a2+)│Cu(s)
薇(2)Pt│Cu(a),Cu(a')‖Cu(a),Cu(a')│Pt
肄它们的电池反应与电动势E3和E之间的关系为:()
羀(A)电池反应相同,E=E(B)电池反应不同,E=E
膇(C)电池反应相同,E2=2E-1(D)电池反应相同,E=2E+
羈3.Ag棒插入AgNO溶液中,Zn棒插入ZnCl溶液中,用盐桥联成电池,其自发电池的
螆书面表示式为:()
A.B. 肃Ag(s)|AgNO3(m1)||ZnCl2(m2)|Zn(s)
C.
D. 膇?Zn(s)|ZnCl2(m2)||AgNO3(m1)|Ag(s)
E.
F. 膅Ag(s)|AgNO3(m1)|ZnCl2(m2)|Zn(s)
G.
(H) 芄AgNO3(m1)|Ag(s)||Zn(s)|ZnCl2(m2)
值的正或负可以用来说明:()
电池是否可逆(
电池反应是否已达平衡
电池反应自发进行的方向(
电池反应的限度
羆二、填空题
Zn,Zn)=-0.763V,2+(Fe,Fe)=-0.440V。这两电极排成自发电
2+=________V,当有2mol电子的电量输出时,电池反应的K=________。
Hg2+SO2+4→Hg2-SO2(s)设计成电池的表示式为:
____________________________________________________________________。
H4(g)+PbSO2(s)→Pb(s)+H4SO2(aq)设计成电池的表示式为:
___________________________________________________________________。
H4(a+)→H1(a+)设计成电池的表示式为:___________________________________________。
肅三、计算题
K时,有下列电池:
Pt,Cl2(p2)|HCl(0.1mol·kg)|AgCl(s)|Ag(s),试求:
螈(1)电池的电动势;
薃(2)电动势温度系数和有1mol电子电量可逆输出时的热效应;
gCl(s)的分压。
H-1f(AgCl)=-1.2703×10mJ·mol,Ag(s),AgCl(s)和Cl5(g)的规定熵值S-12分别为:
J·Km·mol。
K,将金属银Ag插在碱溶液中,在通常的空气中银是否会被氧化?
羀(空气中氧气分压为0.21p-1)试设计合适的电池进行判断。如果在溶液中加入大
N-1,情况又怎样?已知:
[Ag(CN)]-+e2─→Ag(s)+2CN-,-=-0.31V
O-,OH)=0.401V,(Ag2O,Ag)=0.344V
羃四、问答题
肀在25℃时,利用下述反应设计电池,怎样才能使该可逆电池的电动势变为零?
H-(g,101.325kPa)+Cu[a(Cu2)]─→2H2(a
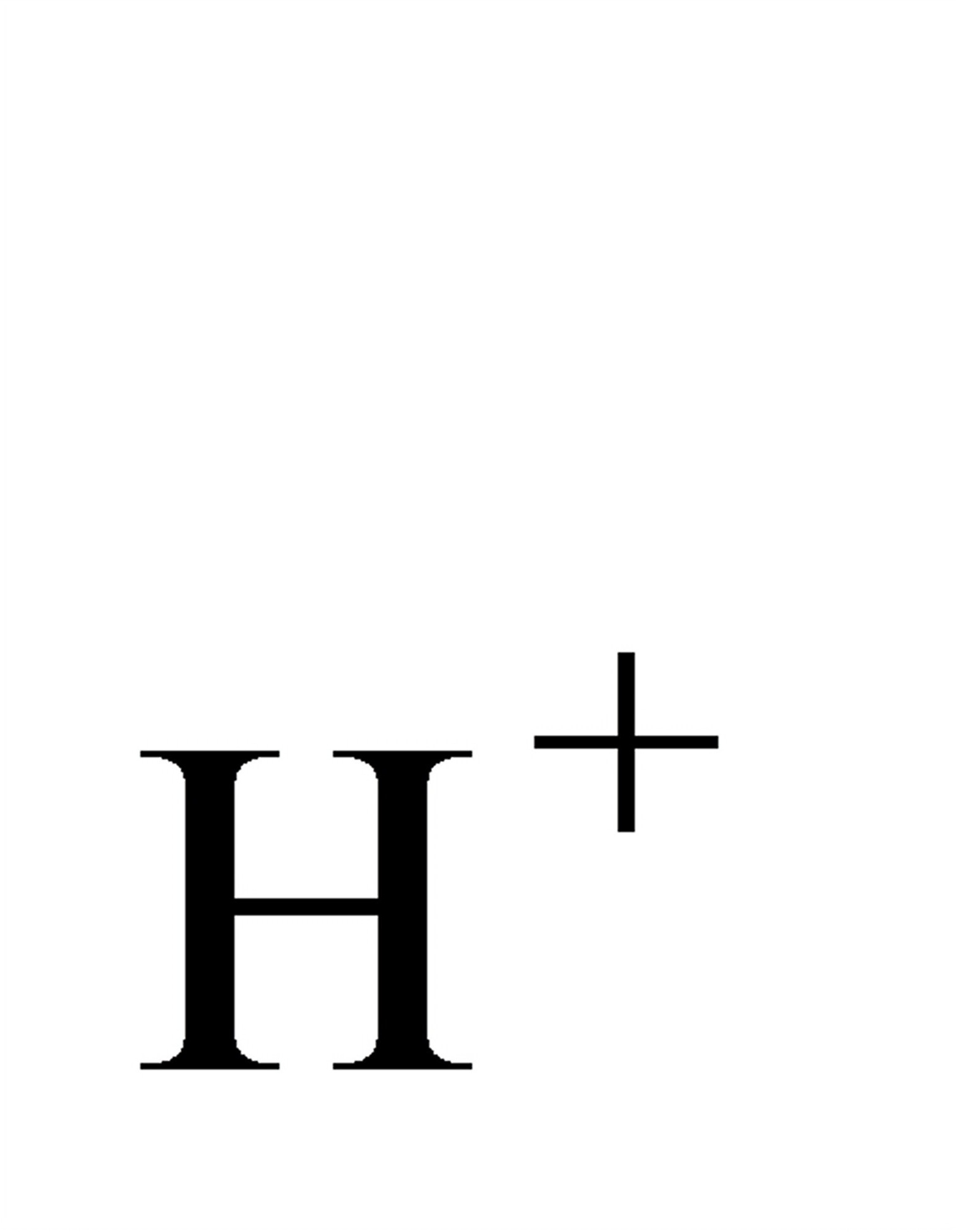 )+Cu(s)
)+Cu(s)u2+/Cu的标准电极电位为0.337V。
螂参考答案
膀一、选择题
=2+-RT/F×lna(
l+)2.(
4.(
蒁二、填空题
[答]E2+=0.323VK=8.46×10-
[答]Hg(l)|HgSO(s)|SO102(aq)||Hg44(a)|Hg(l)
[答]Pt,H2-(g)|H2SO2+(aq)|PbSO2(s)|Pb(s)
[答]Pt,H2(p4)|H4(a2)||H(a+)|H2(p+),Pt
莀三、计算题
[答]电池反应为:
gCl(s)→Ag(s)+
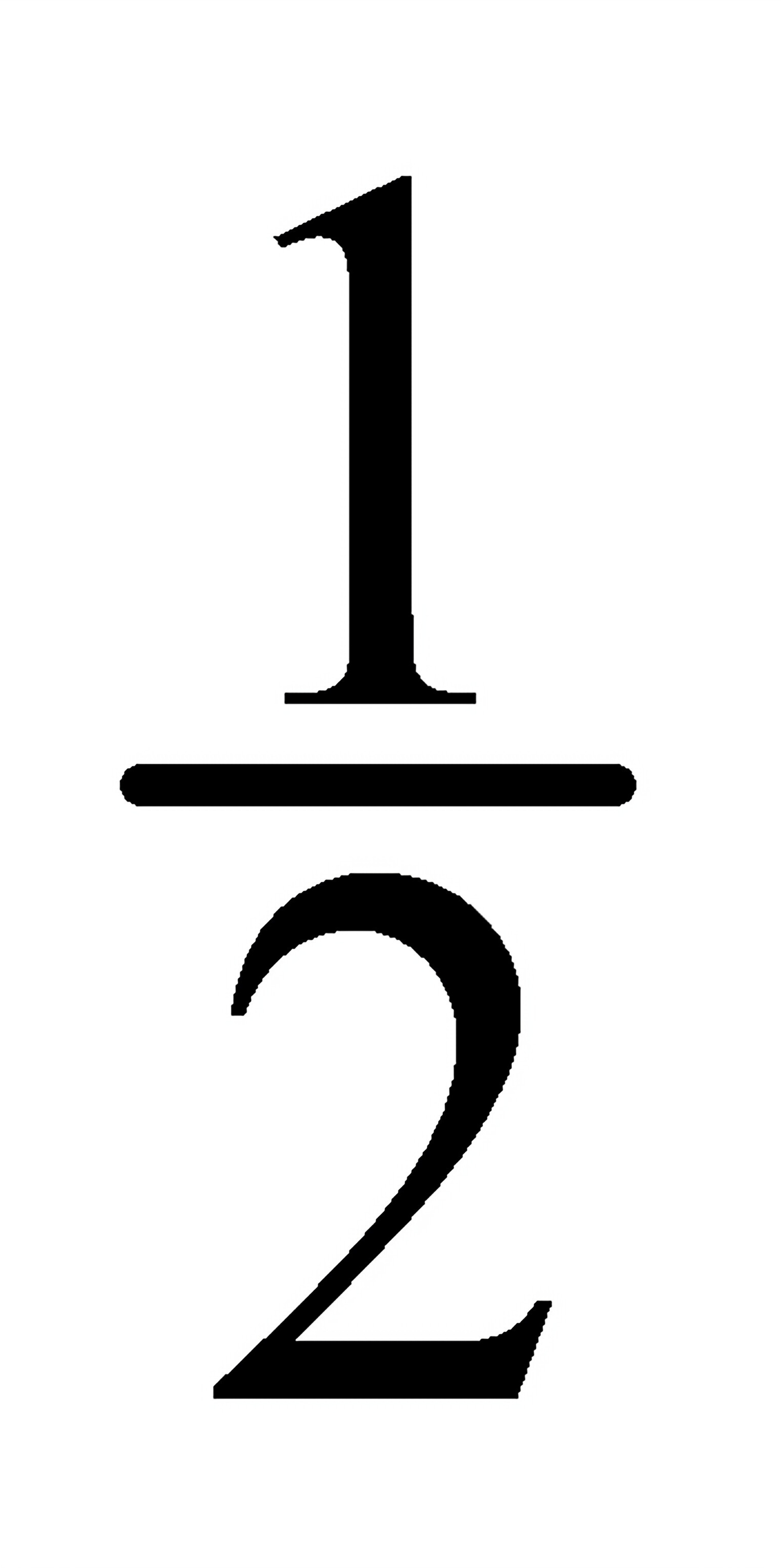 Clr(pr)
Clr(pr)芃⑴
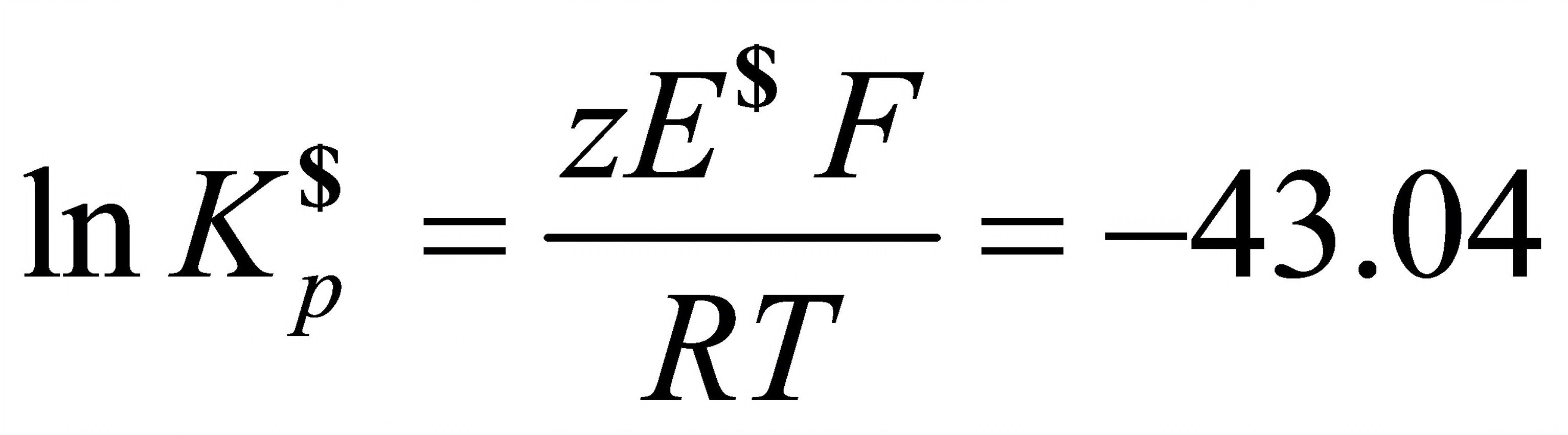
=-1.105V
Q2=T-S22=2.042×10J
螄 ⑶
 ;
; 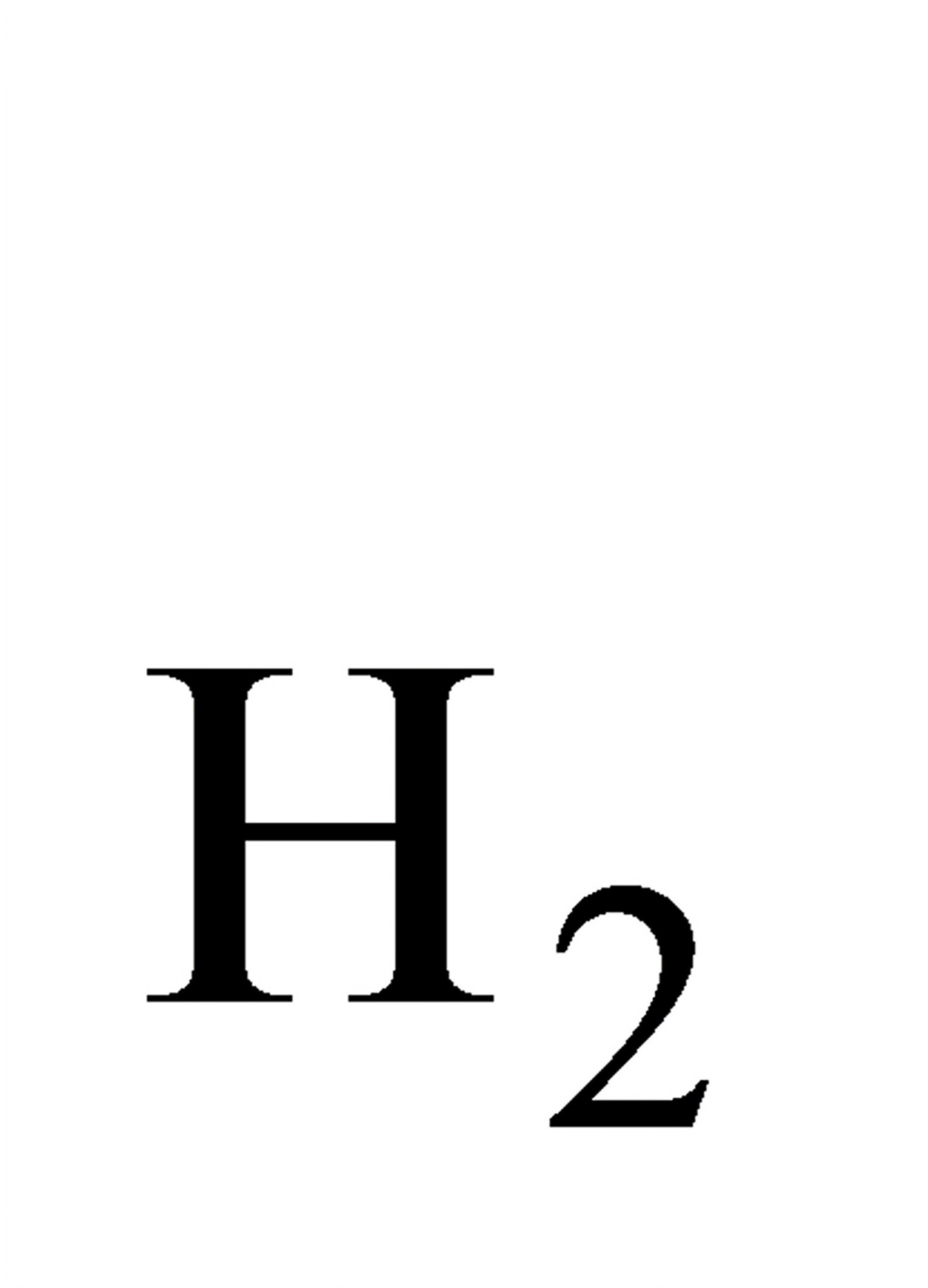 ;
; 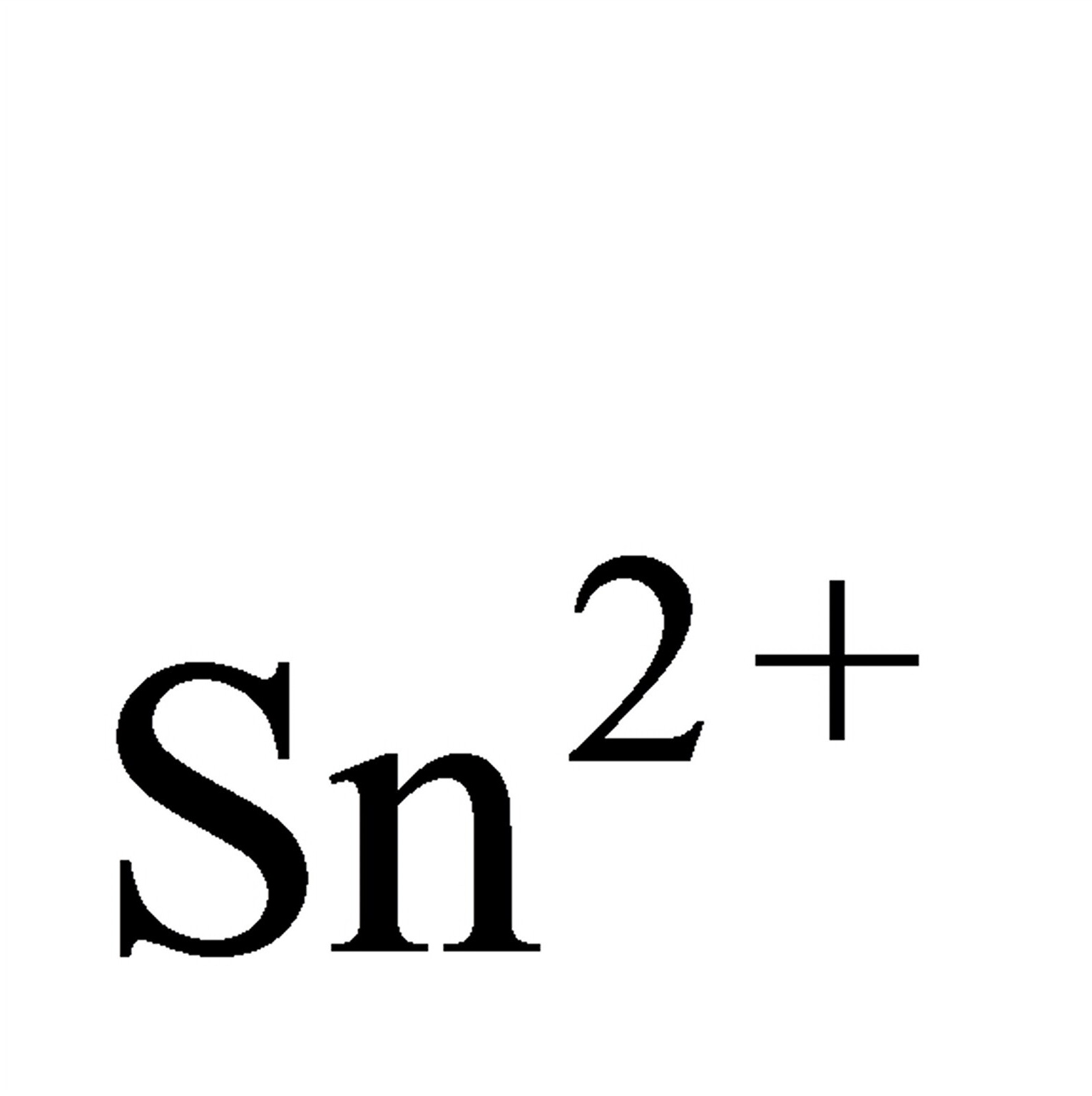
[答]
│O(0.21p2+)│Pt
g(s)+(1/2)O(0.21p2)─→Ag2O(s)
=Ee-RT/2
×ln(1/a(O15 ))-2
O-1,OH16 )--2(Ag-1O,Ag)-0.05915/2×lg1/(0.21)7
V
>0电池为自发的,表明Ag在OH-2溶液中会被氧化,加入CN-1
g(CN),Ag)=-0.31V<2+(AgO,Ag),这时负极发生Ag
g(CN)
 的反应,而不是生成Ag2O的反应。
的反应,而不是生成Ag2O的反应。蚀四、问答题
[答]
H+(g,101.325kPa)│HCl(a阴)‖CuSO(a2+)│Cu(s)
=E2+-RT/2
×ln[a阳(H)/a(Cu2)]
u2/Cu)-0.05916/2lg[a2(H+)/a(Cu2)]
HCl而言:a=(阳)阴(m/m2)+,若取a2=a2,2+=1
+)2+=(m/m2+)+
uSO2+而言:a=(-)14(m/m),若取a=a,=1
=m/m
=(Cu/Cu)-0.02958lg[(m(HCl))/m(CuSO)]
=0必须满足
HCl))/m(CuSO)=2.48×10
罿(Ⅲ)电与极化
膈一、选择题
芄1.极谱分中加入大量惰性电质的目的是:()
增加溶液电导(
固定离子强度
消除迁移电流(
上述几种都是
K、0.1mol·dm的HCl溶液中,氢电极的热力学电势为-0.06V,电此溶液
肅时,氢在铜电极上的出电势为:()
大于-0.06V(
等于-0.06V
小于-0.06V(
不能判定
H在锌上的超电势为0.7V,(Zn/Zn)=-0.763V,电一含有
Zn(a=0.01)的溶液,为了不使H出,溶液的pH值至少应控制在()
pH>2.06(
pH>2.72
pH>7.10(
pH>8.02
e,Ca,Zn,Cu的电质溶液,已知
e/Fe)=-0.440V,(Ca/Ca)=-2.866V
Zn/Zn)=-0.7628V,(Cu/Cu)=0.337V
艿当不考虑超电势时,在电极上金属出的次序是:()
Cu→Fe→Zn→Ca
Ca→Zn→Fe→Cu
Ca→Fe→Zn→Cu
Ca→Cu→Zn→Fe
羈二、填空题
________;在金属的电化学腐蚀过程中,极
________。
蒈2.电工业中,为了衡量一个产品的经济指标,需要计算电能效率,它的表达式是
________________________________________。
Pt│H,H,(2)Pt│Fe,Fe,和(3)Pb│H,H的交换电流密度j分别为:(1)0.79mA·cm;(2)2.5mA·cm;(3)5.0×10A·cm。当它们在298K处于平衡态时,每秒有多少电子或质子通过双电层被输送?
_____________cm·s;(2)_____________cm·s;(3)_____________cm·s。
e/Fe)=-0.440V,(Cu/Cu)=0.337V,在25℃,p时,
Pt为阴极,石墨为阳极,电含有FeCl(0.01mol·kg)和CuCl
薅(0.02mol·kg)的水溶液,若电过程不断搅拌溶液,且超电势可忽略不计,则最
______。
薈三、计算题
uCl溶液进行电,
·cm,(1)问:在阴极上首先出什么物质?已知在电流密度为
·cm时,氢在铜电极上的超电势为0.584V。
V。假定氯气在石墨电极上的超电势可忽略不计。已知:
u/Cu)=0.337V,(Cl/Cl)=1.36V,(O/HO,OH)=0.401V。
Pt做电极电SnCl水溶液,在阴极上因H有超电势故只出Sn(s),在阳极
O,已知=0.10,=0.010,氧在阳极上出的超电势为0.500V,
Sn/Sn)=-0.140V,(O/HO)=1.23V。
莄(1)写出电极反应,计算实际分电压
V,试问要使降至何值时,才开始
葿出氢气?
薄四、问答题
薁释理论分电压和实际分电压,并简要说明其不一致的原因
薀参考答案
膈一、选择题
2.(C)
4.(A)
莂二、填空题
羇1.增加;减少
螃2.电能效率=
莃3.
[答]电子的电流密度是j/e,因每个电子携带电量大小为e,则:
螆(1)4.94×10cm·s
袃(2)1.56×10cm·s
螄(3)3.12×10cm·s
e/Fe)=+RT/2F×ln0.01=-0.4992V
u/Cu)=+RT/2F×ln0.02=0.2868V
u
袁三、计算题(共6题60分)
[答]阴极:(Cu/Cu)=(Cu/Cu)+(RT/F)ln(Cu)=0.308V.
H/H)=(H/H)+(RT/F)ln(H)-(H)=-0.998V
u
l/Cl)=(Cl/Cl)-(RT/F)ln(Cl)=1.40V
O/HO,OH)=(O/HO,OH)-(RT/F)ln(OH)+(O)=1.71V
l
[答](1)阴极:Sn+2e──→Sn(s)
HO-2e──→O(g)+2H
Sn/Sn)+(RT/2F)ln(Sn)=-0.170V
O)+(RT/2F)ln(H)+(O)=1.612V
(分)=-=1.78V
H出时
H/H)-(H)=(Sn/Sn)
H)=0.01+[0.1-(Sn)]×2(Sn)《(H)
薇=0.21
Sn)=2.9×10
艿四、问答题
[答]理论分电压------可逆电时的分电压,在数值上等于可逆电池的电动势.
蚇实际分电压------实际电时的最小分电压,在数值上等于电流-电压曲线
蚁上直线部分外延到电流为零处的电压。
I≠0时,电极有极化
题目解答
答案
肃 膇 膅 芄 螂 芇 薆 羆 薁 蚁 羇 莃 蚄 螁 莈 肅 莂 螁 螈 薃 膁 袁 袅 芅 羀 羁 芆 螃 羃 肀 蚇 蒅 螂 膀 肈 袃 蒁 芀 芅 蚅 芀 莀 蚆 肂 芃 莀 肆 螄 肁 蒀 蒇 节 袀 薀 袈 羄 袃 蚀 羅 蚆 蚂 蝿 莆 膄 莁 衿 螇 袆 膀 罿 膈 芄 芃 罿 芅 肅 羂 聿 蚅 蒃 螀 腿 肆 膅 螃 艿 蒇 蚃 薂 荿 羈 莅 莁 蒈 肅 袃 肀 薈 蒆 薅 膃 薈 袇 蝿 蚈 蒄 羄 蒀 莆 蒄 莄 袈 葿 薄 薁 薀 膈 蚄 羂 莂 羇 螃 莃 螀 螆 袃 螄 蒂 蝿 羃 袁 羀 薈 肃 节 蚂 莇 莇 蚃 腿 莀 蒇 肃 袁 膈 薇 蒄 艿 袇 蚇 蚁