题目
已知(-)Cu|Cu2+(0.10 mol·L-1)‖ClO3-(2.0 mol·L-1),H+(5.0 mol·L-1),Cl-(1.0mol·L-1)|Pt(+),(1)写出原电池反应。(2)计算298K时,电池电动势E,判断反应方向。(3)计算原电池反应的平衡常数Kθ。(θ(Cu2+/Cu)=0.3417V, θ(ClO3-/Cl-)=1.45V)
已知
(-)Cu|Cu2+(0.10 mol·L-1)‖ClO3-(2.0 mol·L-1),H+(5.0 mol·L-1),Cl-(1.0mol·L-1)|Pt(+),(1)写出原电池反应。(2)计算298K时,电池电动势E,判断反应方向。(3)计算原电池反应的平衡常数Kθ。(θ(Cu2+/Cu)=0.3417V, θ(ClO3-/Cl-)=1.45V)
题目解答
答案
解:(1)原电池反应为:
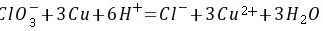
(2)298K时,
正极的电极电位为:
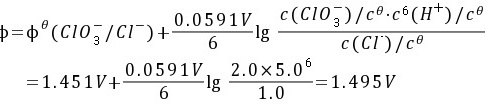
负极的电极电位为:
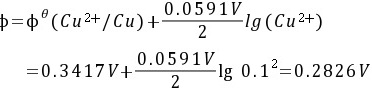
电池的电动势为: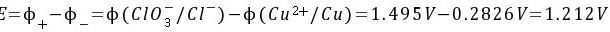
电池电动势E>0,反应向正反应方向进行
(3)电池的标准电动势为: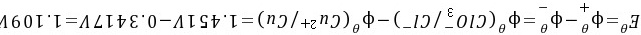
所以 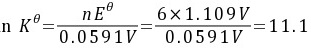
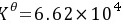
解析
步骤 1:写出原电池反应
原电池反应是通过氧化还原反应来产生电能的反应。在本题中,Cu被氧化,ClO3-被还原。根据电极反应,可以写出原电池反应。
步骤 2:计算298K时电池电动势E
电池电动势E是通过计算正极和负极的电极电位差来得到的。正极的电极电位是通过Nernst方程计算的,负极的电极电位也是通过Nernst方程计算的。
步骤 3:计算原电池反应的平衡常数Kθ
平衡常数Kθ是通过电池的标准电动势Eθ和反应的电子转移数n来计算的。标准电动势Eθ是通过计算正极和负极的标准电极电位差来得到的。
原电池反应是通过氧化还原反应来产生电能的反应。在本题中,Cu被氧化,ClO3-被还原。根据电极反应,可以写出原电池反应。
步骤 2:计算298K时电池电动势E
电池电动势E是通过计算正极和负极的电极电位差来得到的。正极的电极电位是通过Nernst方程计算的,负极的电极电位也是通过Nernst方程计算的。
步骤 3:计算原电池反应的平衡常数Kθ
平衡常数Kθ是通过电池的标准电动势Eθ和反应的电子转移数n来计算的。标准电动势Eθ是通过计算正极和负极的标准电极电位差来得到的。