含有未知数的配平-|||-(1) __ _(x)S+ __ =!=!= __ S-|||-+ __ (Cl)_(2)+ __ H2S含有未知数的配平-|||-(1) __ _(x)S+ __ =!=!= __ S-|||-+ __ (Cl)_(2)+ __ H2S
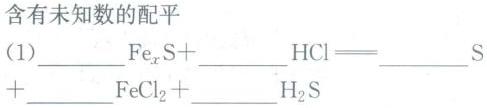
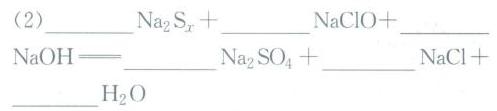
题目解答
答案
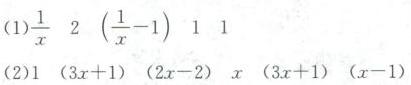
解析
考查要点:本题主要考查化学方程式的配平,特别是含有未知数的复杂配平问题。需要综合运用原子守恒、氧化还原反应电子守恒等原理,结合代数方法建立方程求解。
解题核心思路:
- 确定未知数的系数:将未知数的系数设为变量,通过各元素原子数目守恒建立方程。
- 分步配平:优先配平主元素(如Fe、S、Na、S、Cl等),再处理其他元素(如H、O)。
- 氧化还原反应中的电子守恒:对于含变价元素的反应,需计算电子转移总数,建立电子守恒方程。
破题关键点:
- 第一题:通过Fe的原子守恒确定FeₓS的系数,再通过S和Cl的守恒逐步推导其他系数。
- 第二题:利用S和Cl的氧化态变化计算电子转移,结合原子守恒建立方程组。
(1) ${Fe}_{x}S + HCl \rightarrow S + FeCl_2 + H_2S$
配平Fe原子
设${Fe}_{x}S$的系数为$\dfrac{1}{x}$,则左边Fe原子数为$\dfrac{1}{x} \cdot x = 1$,右边$FeCl_2$的系数为$1$,Fe守恒。
配平S原子
左边${Fe}_{x}S$中S原子数为$\dfrac{1}{x}$,右边$S$和$H_2S$的总S原子数为$b + c = \dfrac{1}{x}$。假设$S$的系数为$1$,则$H_2S$的系数为$\dfrac{1}{x} - 1$。
配平Cl原子
$HCl$的系数为$2$(因为$FeCl_2$中Cl原子数为$2 \cdot 1 = 2$),$H_2S$中无Cl,Cl守恒。
配平H原子
$HCl$的系数为$2$,$H_2S$的系数为$\dfrac{1}{x} - 1$,H原子数为$2 = 2 \cdot \left(\dfrac{1}{x} - 1\right)$,验证成立。
最终系数:$\dfrac{1}{x}$, $2$, $1$, $1$, $\dfrac{1}{x} - 1$。
(2) ${Na}_{2}{S}_{x} + NaClO + NaOH \rightarrow {Na}_{2}SO_4 + NaCl + H_2O$
设${Na}_{2}{S}_{x}$的系数为$1$
根据S原子守恒,${Na}_{2}SO_4$的系数为$x$。
配平Cl原子
$NaClO$的系数为$3x + 1$,$NaCl$的系数为$3x + 1$,Cl守恒。
配平O原子
$NaOH$的系数为$2x - 2$,$H_2O$的系数为$x - 1$,O原子数为$(3x + 1) + (2x - 2) = 4x + (x - 1)$,验证成立。
配平Na原子
左边:$2 \cdot 1 + (3x + 1) + (2x - 2) = 5x + 1$;右边:$2x + (3x + 1)$,验证成立。
最终系数:$1$, $3x + 1$, $2x - 2$, $x$, $3x + 1$, $x - 1$。