从平衡常数计算电动势。已知反应 (H)_(2)O(overset (harpoonup )(leftharpoons ))leftharpoons 2(H)_(2)(leftharpoons )+(O)_(2) 气)在25℃时的平-|||-衡常数 _(p)=9.7times (10)^-81 以及水蒸汽压为3200 Pa。求25℃时电池Pt,H2 (101 325 Pa)|-|||-_(2)S(O)_(4)(0.01mol/kg) |O2(101325Pa),Pt的电动势。在 .01mol/kg(H)_(2)S(O)_(4) 溶液中的离子-|||-平均活度系数 =0.544

题目解答
答案
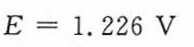
解析
本题主要考察利用平衡常数计算电动势以及能斯特方程的应用,具体步骤如下:
步骤1:确定电极反应与总反应
题目所求电池为:
阳极(氧化):$\text{H}_2(\text{g}) \rightarrow 2\text{H}^+ + 2e^-$
阴极(还原):$\text{O}_2(\text{g}) + 4\text{H}^+ + 4e^- \rightarrow 2\text{H}_2\text{O}(l)$
总反应:$2\text{H}_2(\text{g}) + \text{O}_2(\text{g}) \rightarrow 2\text{H}_2\text{O}(l)$
(注:题目中给出的反应是总反应的逆反应,需注意符号转换。)
步骤2:计算标准电动势$E^\circ$
根据热力学关系,$\Delta_r G^\circ = -RT\ln K_p^\prime$,其中$K_p^\prime$是总反应(正向)的平衡常数,与题目给出的逆反应平衡常数$K_p$互为倒数:
$K_p^\prime = \frac{1}{K_p} = \frac{1}{9.7 \times 10^{-81}} \approx 1.03 \times 10^{80}$
代入公式:
$\Delta_r G^\circ = -RT\ln K_p^\prime = -nFE^\circ$
其中$n=4$(转移电子数),$R=8.314\ \text{J/(mol·K)}$,$T=298\ \text{K}$,$F=96485\ \text{C/mol}$:
$E^\circ = \frac{RT\ln K_p^\prime}{nF} = \frac{8.314 \times 298 \times \ln(1.03 \times 10^{80})}{4 \times 96485} \approx 1.229\ \text{V}$
步骤3:计算电池电动势$E$
利用能斯特方程:
$E = E^\circ - \frac{RT}{nF}\ln\left( \frac{a_{\text{H}_2\text{O}}^2}{a_{\text{H}_2}^2 \cdot a_{\text{O}_2} \cdot a_{\text{H}^+}^4} \right)$
活度处理:
- 纯液体$a_{\text{H}_2\text{O}}=1$;
- 气体$a_{\text{H}_2}=a_{\text{O}_2}=1$(101325 Pa视为标准态);
- 硫酸溶液中$\text{H}^+$浓度:$m_{\text{H}^+}=0.02\ \text{mol/kg}$($\text{H}_2\text{SO}_4$解离为$2\text{H}^+ + \text{SO}_4^{2-}$),平均活度系数$\gamma_\pm=0.544$,故$a_{\text{H}^+}=m_{\text{H}^+}\gamma_\pm / m^\circ = 0.02 \times 0.544 = 0.01088$。
代入能斯特方程:
$E \approx 1.229 - \frac{8.314 \times 298}{4 \times 96485}\ln\left( \frac{1}{(1)^2 \cdot (1) \cdot (0.01088)^4} \right) \approx 1.226\ \text{V}$