题目
某干燥白色固体可能含有Na2CO3、NaHCO3、NaOH中的几种,取一定质量的该固体加蒸馏水配制成100mL溶液,并向该溶液中滴加0.5mol/L的盐酸,得到CO2体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:↑CO2体积/L-|||-0.672 B-|||-A-|||-0' V1 V2 盐酸体积 (1)产生的CO2的物质的量为 ____ mol,AB段发生反应的化学方程式为 ____ 。(2)若白色固体由0.02molNa2CO3和xmolNaHCO3组成,则x= ____ ,V1= ____ ,V2= ____ 。(3)若白色固体由NaHCO3和NaOH组成,2V1=V2,则NaHCO3与NaOH溶于水后发生反应的离子方程式为 ____ ,n(NaHCO3):n(NaOH)= ____ 。
某干燥白色固体可能含有Na2CO3、NaHCO3、NaOH中的几种,取一定质量的该固体加蒸馏水配制成100mL溶液,并向该溶液中滴加0.5mol/L的盐酸,得到CO2体积(换算成标准状况下)与盐酸体积的关系如图所示。请回答下列问题:
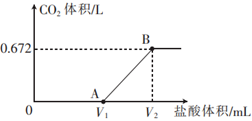
(1)产生的CO2的物质的量为 ____ mol,AB段发生反应的化学方程式为 ____ 。
(2)若白色固体由0.02molNa2CO3和xmolNaHCO3组成,则x= ____ ,V1= ____ ,V2= ____ 。
(3)若白色固体由NaHCO3和NaOH组成,2V1=V2,则NaHCO3与NaOH溶于水后发生反应的离子方程式为 ____ ,n(NaHCO3):n(NaOH)= ____ 。

(1)产生的CO2的物质的量为 ____ mol,AB段发生反应的化学方程式为 ____ 。
(2)若白色固体由0.02molNa2CO3和xmolNaHCO3组成,则x= ____ ,V1= ____ ,V2= ____ 。
(3)若白色固体由NaHCO3和NaOH组成,2V1=V2,则NaHCO3与NaOH溶于水后发生反应的离子方程式为 ____ ,n(NaHCO3):n(NaOH)= ____ 。
题目解答
答案
(1)0.03 NaHCO3+HCl=CO2↑+H2O+NaCl
(2)0.01 40 100
(3)HCO3-+OH-=CO32-+H2O 1:1
【分析】开始阶段没有二氧化碳产生,说明混合后的成分为碳酸氢钠和碳酸钠,或碳酸钠和氢氧化钠,结合图像、物质的性质和问题分析解答。
【详解】(1)根据图像可知产生的CO2在标况下的体积是0.672L,物质的量为0.672L÷22.4L/mol=0.03mol,AB段是碳酸氢钠和盐酸反应生成二氧化碳,发生反应的化学方程式为NaHCO3+HCl=CO2↑+H2O+NaCl。
(2)混合物中碳酸钠是0.02mol,依据碳原子守恒可知碳酸氢钠的物质的量是0.03mol-0.02mol=0.01mol;开始阶段碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,方程式为Na2CO3+HCl=NaHCO3+NaCl,消耗盐酸是0.02mol,盐酸的体积是0.02mol÷0.5mol/L=0.04L=40mL;AB段发生反应的化学方程式为NaHCO3+HCl=CO2↑+H2O+NaCl,该阶段消耗盐酸是0.03mol,盐酸的体积是0.03mol÷0.5mol/L=0.06L=60mL,所以V2=40+60=100;
(3)若白色固体由NaHCO3和NaOH组成,溶于水后NaHCO3与NaOH发生反应生成碳酸钠和水,反应的离子方程式为HCO3-+OH-=CO32-+H2O,由于2V1=V2,根据NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=CO2↑+H2O+NaCl可知二者恰好反应生成碳酸钠和水,所以n(NaHCO3):n(NaOH)=1:1。
(2)0.01 40 100
(3)HCO3-+OH-=CO32-+H2O 1:1
【分析】开始阶段没有二氧化碳产生,说明混合后的成分为碳酸氢钠和碳酸钠,或碳酸钠和氢氧化钠,结合图像、物质的性质和问题分析解答。
【详解】(1)根据图像可知产生的CO2在标况下的体积是0.672L,物质的量为0.672L÷22.4L/mol=0.03mol,AB段是碳酸氢钠和盐酸反应生成二氧化碳,发生反应的化学方程式为NaHCO3+HCl=CO2↑+H2O+NaCl。
(2)混合物中碳酸钠是0.02mol,依据碳原子守恒可知碳酸氢钠的物质的量是0.03mol-0.02mol=0.01mol;开始阶段碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,方程式为Na2CO3+HCl=NaHCO3+NaCl,消耗盐酸是0.02mol,盐酸的体积是0.02mol÷0.5mol/L=0.04L=40mL;AB段发生反应的化学方程式为NaHCO3+HCl=CO2↑+H2O+NaCl,该阶段消耗盐酸是0.03mol,盐酸的体积是0.03mol÷0.5mol/L=0.06L=60mL,所以V2=40+60=100;
(3)若白色固体由NaHCO3和NaOH组成,溶于水后NaHCO3与NaOH发生反应生成碳酸钠和水,反应的离子方程式为HCO3-+OH-=CO32-+H2O,由于2V1=V2,根据NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=CO2↑+H2O+NaCl可知二者恰好反应生成碳酸钠和水,所以n(NaHCO3):n(NaOH)=1:1。
解析
本题考查碳酸盐与盐酸反应的图像分析,需结合物质的量、化学反应方程式的计算。解题关键在于:
- 确定反应阶段:根据图像判断反应分段,明确各阶段对应的化学反应;
- 守恒与关系式:利用碳守恒、盐酸用量与反应阶段的关系求解未知量;
- 混合物组成分析:根据题目条件推断固体成分及反应产物。
(1)CO₂的物质的量与AB段反应方程式
- CO₂物质的量:
标准状况下,$V(\text{CO}_2)=0.672\text{L}$,则物质的量为:
$n(\text{CO}_2)=\frac{0.672}{22.4}=0.03\text{ mol}$ - AB段反应:
AB段为碳酸氢钠与盐酸反应生成二氧化碳,方程式为:
$\text{NaHCO}_3 + \text{HCl} \rightarrow \text{CO}_2\uparrow + \text{H}_2\text{O} + \text{NaCl}$
(2)混合物组成与盐酸体积计算
- 碳酸氢钠的物质的量:
碳酸钠与盐酸反应生成碳酸氢钠:
$\text{Na}_2\text{CO}_3 + \text{HCl} \rightarrow \text{NaHCO}_3 + \text{NaCl}$
已知$n(\text{Na}_2\text{CO}_3)=0.02\text{ mol}$,根据碳守恒,总$n(\text{CO}_2)=0.03\text{ mol}$,则:
$n(\text{NaHCO}_3)=0.03 - 0.02=0.01\text{ mol}$ - V₁的计算:
碳酸钠消耗盐酸的物质的量为$0.02\text{ mol}$,对应体积:
$V_1=\frac{0.02}{0.5}=0.04\text{ L}=40\text{ mL}$ - V₂的计算:
AB段碳酸氢钠消耗盐酸的物质的量为$0.03\text{ mol}$,对应体积:
$V(\text{AB段})=\frac{0.03}{0.5}=0.06\text{ L}=60\text{ mL}$
总盐酸体积:
$V_2=V_1 + V(\text{AB段})=40 + 60=100\text{ mL}$
(3)离子方程式与物质的量比
- 反应方程式:
碳酸氢钠与氢氧化钠反应生成碳酸钠:
$\text{HCO}_3^- + \text{OH}^- \rightarrow \text{CO}_3^{2-} + \text{H}_2\text{O}$ - 物质的量比:
根据$2V_1=V_2$,结合盐酸滴定过程,可推导$n(\text{NaHCO}_3):n(\text{NaOH})=1:1$。