题目
1.下列说法中正确的是 ( ) A.电子云通常是用小黑点来表示电子的多少B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动C.处于最低能量状态的原子叫基态原子D.电子仅由激发态跃迁到基态时才会产生原子光谱2.下列轨道上的电子在xy平面上出现的机会为零的是( )A.3pz B.3px C.3py D.3s3.“各能级最多容纳的电子数是该能级原子轨道数的两倍”,支撑这一结论的理论是 ( )A.构造原理 B.泡利原理C.洪特规则 D.能量最低原理4.某原子核外电子排布为ns2np7,它违背了 ( )A.能量最低原理 B.泡利不相容原理C.洪特规则 D.洪特规则特例5.在d轨道中电子排布成,而不排布成,遵循的是 ( )A.能量最低原理 B.泡利原理C.原子轨道构造原理 D.洪特规则6.下列排布不符合泡利原理的是 ( )A.2p能级:B.3d能级:C.2p能级:D.3d能级:7.某元素的3p能级上有两个未成对电子,因此其 ( )A.第三能层上有4个电子B.最高正价为+2价C.最高正价为+4价D.第二电子层没有未成对电子8.人们常将在同一原子轨道上运动的、自旋状态相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关原子中“未成对电子”的说法中错误的是 ( )A.l的原子轨道中一定含有“未成对电子”B.Mg的原子轨道中一定不含有“未成对电子”C.的原子轨道中不可能含有“未成对电子”D.F的原子轨道中一定含有“未成对电子”9.激发态原子和基态原子可以通过电子跃迁的方式相互转换,跃迁过程中可得到光谱,下列说法正确的是 ( )A.元素K的焰色呈紫红色,其中紫色对应的辐射波长约为700nmB.以下实验装置测得的是氢元素的吸收光谱图L1-1-2C.,该电子排布图表示的是基态氧原子的电子排布图D.原子光谱可以用于定性鉴定元素10.下列粒子中第一、第二层电子数总和等于其第三、第四层电子数总和的是 ( )A.K B.Ca C.Mg D.S11.下列有关核外电子排布的式子不正确的是 ( )A.24Cr的电子排布式:1s22s22p63s23p63d54s1B.K的简化电子排布式:[Ar]4s1C.N原子的电子排布图:D.S原子的电子排布图:12.下列说法中正确的是 ( )A.M层有3s、3p、3d、3f能级B.同一原子中,3d轨道的能量小于4s轨道的能量C.1s22s12p1表示的不是基态原子的电子排布D.同一原子中,2p、3p、4p电子的能量逐渐减小13.以下核外电子的表示方法中,能表示该原子处于能量最低状态的是 ( )A.N: B.F:C.Fe:[Ar]3d54s2 D.Cu:[Ar]3d104s114.基态碳原子的最外能层的各能级中,电子排布的方式正确的是 ( )A. B.C. D.
1.下列说法中正确的是 ( )
A.电子云通常是用小黑点来表示电子的多少
B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C.处于最低能量状态的原子叫基态原子
D.电子仅由激发态跃迁到基态时才会产生原子光谱
2.下列轨道上的电子在xy平面上出现的机会为零的是( )
A.3pz B.3px C.3py D.3s
3.“各能级最多容纳的电子数是该能级原子轨道数的两倍”,支撑这一结论的理论是 ( )
A.构造原理 B.泡利原理
C.洪特规则 D.能量最低原理
4.某原子核外电子排布为ns2np7,它违背了 ( )
A.能量最低原理 B.泡利不相容原理
C.洪特规则 D.洪特规则特例
5.在d轨道中电子排布成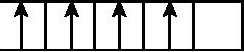 ,而不排布成
,而不排布成 ,遵循的是 ( )
,遵循的是 ( )
 ,而不排布成
,而不排布成 ,遵循的是 ( )
,遵循的是 ( )A.能量最低原理 B.泡利原理
C.原子轨道构造原理 D.洪特规则
6.下列排布不符合泡利原理的是 ( )
A.2p能级: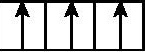
B.3d能级: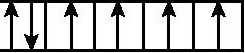
C.2p能级: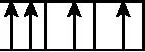
D.3d能级: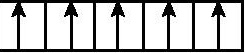
7.某元素的3p能级上有两个未成对电子,因此其 ( )
A.第三能层上有4个电子
B.最高正价为+2价
C.最高正价为+4价
D.第二电子层没有未成对电子
8.人们常将在同一原子轨道上运动的、自旋状态相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关原子中“未成对电子”的说法中错误的是 ( )
A.l的原子轨道中一定含有“未成对电子”
B.Mg的原子轨道中一定不含有“未成对电子”
C.的原子轨道中不可能含有“未成对电子”
D.F的原子轨道中一定含有“未成对电子”
9.激发态原子和基态原子可以通过电子跃迁的方式相互转换,跃迁过程中可得到光谱,下列说法正确的是 ( )
A.元素K的焰色呈紫红色,其中紫色对应的辐射波长约为700nm
B.以下实验装置测得的是氢元素的吸收光谱
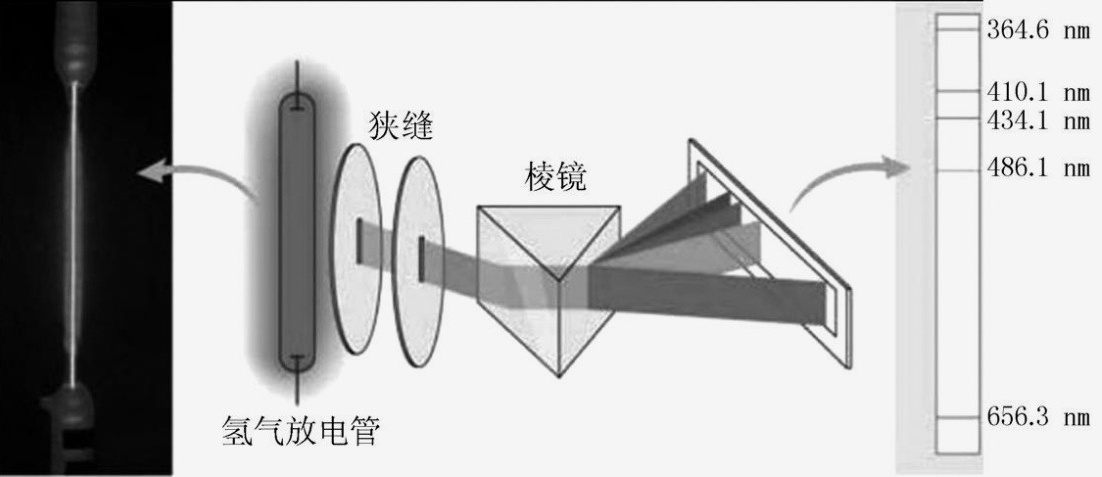
图L1-1-2
C.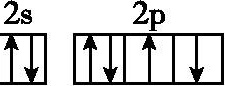 ,该电子排布图表示的是基态氧原子的电子排布图
,该电子排布图表示的是基态氧原子的电子排布图
D.原子光谱可以用于定性鉴定元素
10.下列粒子中第一、第二层电子数总和等于其第三、第四层电子数总和的是 ( )
A.K B.Ca C.Mg D.S
11.下列有关核外电子排布的式子不正确的是 ( )
A.24Cr的电子排布式:1s22s22p63s23p63d54s1
B.K的简化电子排布式:[Ar]4s1
C.N原子的电子排布图: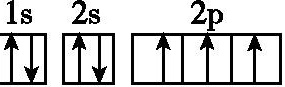
D.S原子的电子排布图: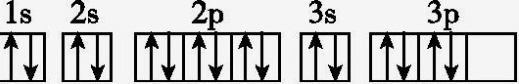
12.下列说法中正确的是 ( )
A.M层有3s、3p、3d、3f能级
B.同一原子中,3d轨道的能量小于4s轨道的能量
C.1s22s12p1表示的不是基态原子的电子排布
D.同一原子中,2p、3p、4p电子的能量逐渐减小
13.以下核外电子的表示方法中,能表示该原子处于能量最低状态的是 ( )
A.N: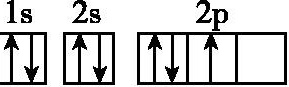 B.F:
B.F: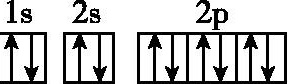
C.Fe:[Ar]3d54s2 D.Cu:[Ar]3d104s1
14.基态碳原子的最外能层的各能级中,电子排布的方式正确的是 ( )
A.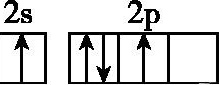 B.
B.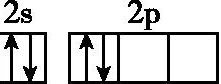
C.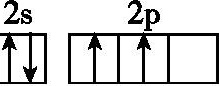 D.
D.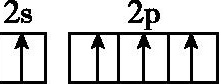
题目解答
答案
1.C 解析:电子云是用小黑点表示电子在核外空间某处出现的概率,小黑点的疏密表示出现概率的大小,A错误;通常能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动,B错误;基态原子的能量最低,C正确;电子由基态跃迁到激发态,或由激发态跃迁到基态,都会产生原子光谱,D错误。
2.A 解析:px和py在xy平面上;3pz轨道沿z轴方向伸展,垂直于xy平面,故该轨道上的电子不可能出现在xy平面上;s轨道电子云为球形,各个方向都有,故A符合题意。
3.B 解析:根据泡利原理,每个原子轨道中最多能容纳2个自旋状态相反的电子,所以每个能级最多能容纳的电子数是该能级原子轨道数的2倍,选项B符合题意。
4.B 解析:泡利原理是指每个轨道最多只能容纳两个自旋相反的电子;能量最低原理是指核外电子优先排布能量最低的轨道;洪特规则是指在相同能量的轨道上,电子在排布的时候优先进入空轨道,每个轨道中的单电子取得相同自旋方向;洪特规则特例是指全充满、半充满、全空状态都是稳定状态。np能级有3个轨道,根据泡利原理最多只能排布6个电子,所以np能级排布7个电子,违背了泡利原理。
5.D 解析:洪特规则表明,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
6.C 解析:3个电子分布在2p能级的三个不同轨道中,每个轨道容纳一个电子,符合泡利原理,故A正确;3d能级的一个原子轨道中最多容纳了两个电子,并且这两个电子的自旋方向相反,故B正确;2p能级上一个原子轨道中容纳的两个电子自旋方向相同,不符合泡利原理,故C错误;5个电子分布在3d能级的五个不同轨道中,每个轨道容纳一个电子,符合泡利原理,故D正确。
7.D 解析:由于3p能级上有两个未成对电子,所以该原子的电子排布式为1s22s22p63s23p2或者1s22s22p63s23p4,分析可知,D正确。
8.C 解析:Al的核外电子排布式为1s22s22p63s23p1,Mg的核外电子排布式为1s22s22p63s2,C的核外电子排布式为1s22s22p2,F的核外电子排布式为1s22s22p5,故四种原子的原子轨道中未成对电子数分别为1、0、2、1,故C项错误。
9.D 解析:元素K的焰色呈紫色,其中紫色波长介于380nm~420nm之间,故A错误;该实验装置测得的是氢元素原子发射光谱,故B错误;根据洪特规则,基态氧原子的电子排布图为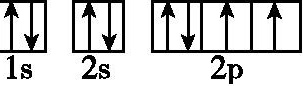 ,故C错误;原子光谱可以用于定性鉴定元素,故D正确。
,故C错误;原子光谱可以用于定性鉴定元素,故D正确。
 ,故C错误;原子光谱可以用于定性鉴定元素,故D正确。
,故C错误;原子光谱可以用于定性鉴定元素,故D正确。10.B 解析:K是19号元素,第一、第二层电子数总和=2+8=10,第三、第四层电子数总和=8+1=9,故A不符;Ca是20号元素,第一、第二层电子数总和=2+8=10,第三、第四层电子数总和=8+2=10,故B符合;Mg是12号元素,第一、第二层电子数总和=2+8=10,第三、第四层电子数总和=2+0=2,故C不符;S是16号元素,第一、第二层电子数总和=2+8=10,第三、第四层电子数总和=6+0=6,故D不符。
11.D 解析:S原子的电子排布图违反了洪特规则,正确的应是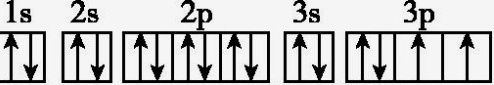 。
。
 。
。12.C 解析:在第三能层中有3s、3p、3d,只有3个亚层共9个原子轨道,故A错误;同一原子中,填充电子时应先充满4s而后才填入3d轨道,4s反而比3d的能量小,故B错误;1s22s12p1为激发态,根据能量最低原理,其基态应为1s22s2,故C正确;根据构造原理,各能级能量由低到高的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f……,同一原子中,2p、3p、4p电子的能量逐渐增大,故D错误。
13.D 解析:A选项不符合洪特规则,2p轨道上的3个电子分占三个轨道时能量最低;B选项中F的电子排布图应为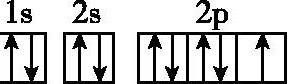 ;C选项中Fe是26号元素,而非25号元素,应为[Ar]3d64s2;D选项符合洪特规则,原子处于能量最低状态。
;C选项中Fe是26号元素,而非25号元素,应为[Ar]3d64s2;D选项符合洪特规则,原子处于能量最低状态。
 ;C选项中Fe是26号元素,而非25号元素,应为[Ar]3d64s2;D选项符合洪特规则,原子处于能量最低状态。
;C选项中Fe是26号元素,而非25号元素,应为[Ar]3d64s2;D选项符合洪特规则,原子处于能量最低状态。14.C 解析:A项中,E2s<E2p,电子应先排满2s再排2p,且2p轨道上的2个电子自旋状态应相同;B项中,2p轨道上的2个电子应分占两个轨道且自旋状态相同;C项中,符合能层能级的能量关系及排布规则;D项中,属于激发态原子的电子排布式。