题目
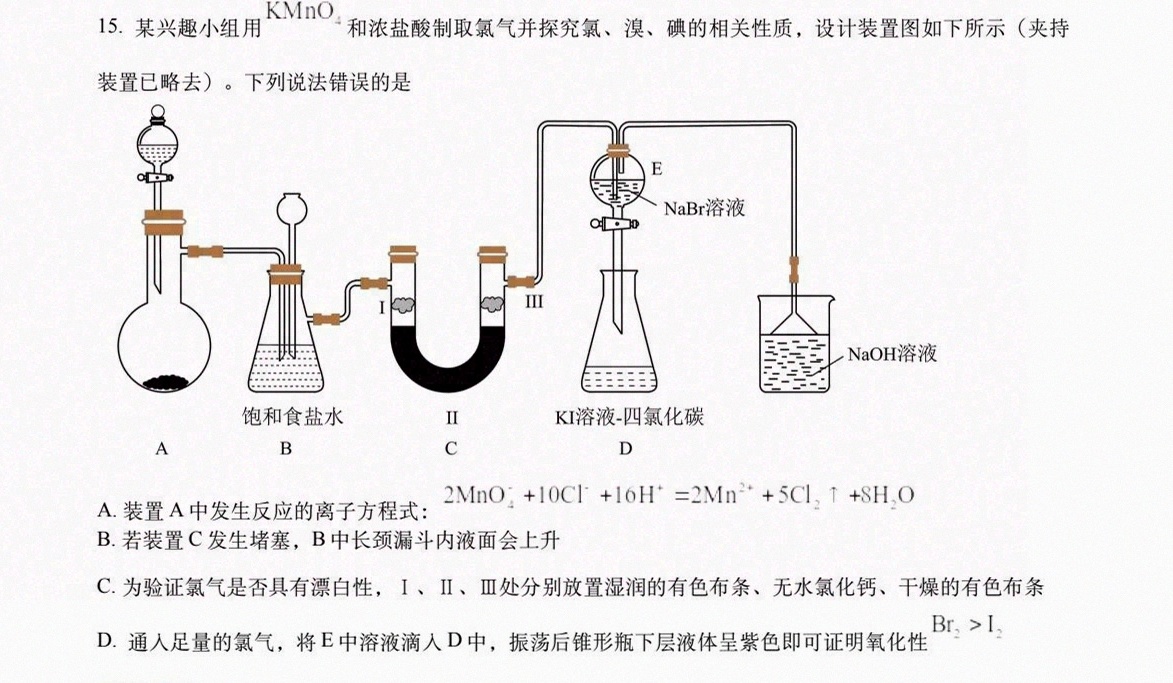
15.某兴趣小组用KMnO和浓盐酸制取氯气并探究氯、溴、碘的相关性质,设计装置图如下所示(夹持-|||-装置已略去)。下列说法错误的是-|||-Q-|||-o-|||-E-|||-C NaBr溶液-|||-Ⅲ-|||-NaOH溶液-|||-三-|||-饱和食盐水 Ⅱ KI溶液-四氯化碳-|||-A B C D-|||-A.装置A中发生反应的离子方程式: (Mn{O)_(4)}^-+10(Cl)^-+10(H)^+=2(Mn)^2++5(Cl)_(2)uparrow +8(H)_(2)O-|||-B.若装置C发生堵塞,B中长颈漏斗内液面会上升-|||-C.为验证氯气是否具有漂白性,I、Ⅱ、Ⅲ处分别放置湿润的有色布条、无水氯化钙、干燥的有色布条-|||-D.通入足量的氯气,将E中溶液滴入D中,振荡后锥形瓶下层液体呈紫色即可证明氧化性 _(2)gt (I)_(2)
题目解答
答案

解析
步骤 1:分析装置A中的反应
装置A中,高锰酸钾(KMnO4)和浓盐酸(HCl)反应生成氯气(Cl2)、锰离子(Mn2+)和水(H2O)。反应的离子方程式为:$2{Mn{O}_{4}}^{-}+10{Cl}^{-}+16{H}^{+}=2{Mn}^{2+}+5{Cl}_{2}\uparrow +8{H}_{2}O$。题目中给出的方程式是正确的,但需要指出的是,反应中H+的系数应为16,而不是10。
步骤 2:分析装置C堵塞时的现象
若装置C发生堵塞,B中长颈漏斗内的液面会上升,因为气体无法通过C装置排出,导致B中压强增大,液面被压高。
步骤 3:验证氯气是否具有漂白性
为验证氯气是否具有漂白性,I、Ⅱ、Ⅲ处分别放置湿润的有色布条、无水氯化钙(干燥剂)、干燥的有色布条。湿润的有色布条会因次氯酸(HClO)的漂白作用而褪色,而干燥的有色布条不会褪色,从而证明氯气本身没有漂白性。
步骤 4:分析氧化性实验
通入足量的氯气,将E中溶液滴入D中,振荡后锥形瓶下层液体呈紫色,这表明溴单质(Br2)被氯气氧化生成了碘单质(I2),但不能直接证明氧化性${Br}_{2}\gt {I}_{2}$,因为氯气也能直接氧化碘离子(I-)生成碘单质(I2)。
装置A中,高锰酸钾(KMnO4)和浓盐酸(HCl)反应生成氯气(Cl2)、锰离子(Mn2+)和水(H2O)。反应的离子方程式为:$2{Mn{O}_{4}}^{-}+10{Cl}^{-}+16{H}^{+}=2{Mn}^{2+}+5{Cl}_{2}\uparrow +8{H}_{2}O$。题目中给出的方程式是正确的,但需要指出的是,反应中H+的系数应为16,而不是10。
步骤 2:分析装置C堵塞时的现象
若装置C发生堵塞,B中长颈漏斗内的液面会上升,因为气体无法通过C装置排出,导致B中压强增大,液面被压高。
步骤 3:验证氯气是否具有漂白性
为验证氯气是否具有漂白性,I、Ⅱ、Ⅲ处分别放置湿润的有色布条、无水氯化钙(干燥剂)、干燥的有色布条。湿润的有色布条会因次氯酸(HClO)的漂白作用而褪色,而干燥的有色布条不会褪色,从而证明氯气本身没有漂白性。
步骤 4:分析氧化性实验
通入足量的氯气,将E中溶液滴入D中,振荡后锥形瓶下层液体呈紫色,这表明溴单质(Br2)被氯气氧化生成了碘单质(I2),但不能直接证明氧化性${Br}_{2}\gt {I}_{2}$,因为氯气也能直接氧化碘离子(I-)生成碘单质(I2)。