题目
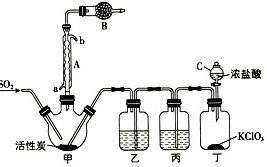
B-|||-b-|||-A C 浓盐酸-|||-602 a-|||-活性炭一 KClO3-|||-甲 乙 丙 丁硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,也可用于制造医药、染料、农药等。有关物质的部分性质如表。 物质 熔点/℃ 沸点/℃ 其它性质 SO2Cl2 -54.1 69.1 ①易水解,产生大量白雾②易分解:SO2Cl2frac(underline{;100℃;)}{}SO2↑+Cl↑ H2SO4 10.4 338 具有吸水性且不易分解 实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为SO2(g)+Cl2(g)⇌SO2Cl2(l)△H=-92.4kJ•mol-1。装置如图所示(夹持仪器已略),请回答有关问题:(1)仪器A的名称为 ____ ,装置丙所装试剂为 ____ 。(2)若无装置乙会对实验造成的影响为 ____ 。(用相应化学方程式说明)(3)仪器B所装试剂为 ____ ,作用是 ____ 。(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 ____ 。(填序号)a.先通冷凝水,再通气b.控制气流速率,速率不宜太快c.加热三颈烧瓶d.若三颈烧瓶发烫,可适当降温(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,此方法得到的产品中会混有硫酸,从分解产物中分离出硫酰氯的方法是 ____ 。(6)SO2是大气污染物之一,工业上要进行废气处理,现用Fe2(SO4)3酸性溶液对其进行处理,发生反应的离子方程式为 ____ 。
 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,也可用于制造医药、染料、农药等。有关物质的部分性质如表。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,也可用于制造医药、染料、农药等。有关物质的部分性质如表。| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{}$SO2↑+Cl↑ |
| H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
(1)仪器A的名称为 ____ ,装置丙所装试剂为 ____ 。
(2)若无装置乙会对实验造成的影响为 ____ 。(用相应化学方程式说明)
(3)仪器B所装试剂为 ____ ,作用是 ____ 。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 ____ 。(填序号)
a.先通冷凝水,再通气
b.控制气流速率,速率不宜太快
c.加热三颈烧瓶
d.若三颈烧瓶发烫,可适当降温
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,此方法得到的产品中会混有硫酸,从分解产物中分离出硫酰氯的方法是 ____ 。
(6)SO2是大气污染物之一,工业上要进行废气处理,现用Fe2(SO4)3酸性溶液对其进行处理,发生反应的离子方程式为 ____ 。
题目解答
答案
解:(1)仪器A为球形冷凝管,装置丙中利用饱和食盐水除去挥发的HCl,
故答案为:球形冷凝管;饱和食盐水;
(2)装置乙是干燥氯气,若无乙装置,将有水蒸气进入三颈烧瓶中,SO2Cl2水解生成HCl和H2SO4,发生反应的化学方程式为SO2Cl2+2H2O=HCl+H2SO4,
故答案为:SO2Cl2+2H2O=HCl+H2SO4;
(3)装置B的作用是吸收含有氯气和SO2的尾气,防止污染环境,同时防止空气中的水进入三颈烧瓶,使SO2Cl2水解,则应选择碱石灰,
故答案为:碱石灰;吸收未反应的氯气和SO2,防止污染空气,同时防止空气中的水进入甲中,使SO2Cl2水解;
(4)a.先通冷凝水,再通气体,可提高反应物的利用率,增大产率,故a正确;
b.控制气流速率,宜慢不宜快,可提高反应物的利用率,增大产率,故b正确;
c.为放热反应,加热三颈烧瓶,平衡逆向移动,产率减小,故c错误;
d.正反应为放热反应,若三颈烧瓶发烫,可适当降温,使平衡正向移动,增大产率,故d正确;
故答案为:abd;
(5)反应后得到液体混合物互溶,沸点不同,可选蒸馏 (温度范围在69.1℃以上,100℃以下)分离出硫酰氯,
故答案为:蒸馏;
(6)SO2通入Fe2(SO4)3酸性溶液中,Fe3+能将SO2氧化为硫酸,发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++4H++SO42-,
故答案为:2Fe3++SO2+2H2O=2Fe2++4H++SO42-。
故答案为:球形冷凝管;饱和食盐水;
(2)装置乙是干燥氯气,若无乙装置,将有水蒸气进入三颈烧瓶中,SO2Cl2水解生成HCl和H2SO4,发生反应的化学方程式为SO2Cl2+2H2O=HCl+H2SO4,
故答案为:SO2Cl2+2H2O=HCl+H2SO4;
(3)装置B的作用是吸收含有氯气和SO2的尾气,防止污染环境,同时防止空气中的水进入三颈烧瓶,使SO2Cl2水解,则应选择碱石灰,
故答案为:碱石灰;吸收未反应的氯气和SO2,防止污染空气,同时防止空气中的水进入甲中,使SO2Cl2水解;
(4)a.先通冷凝水,再通气体,可提高反应物的利用率,增大产率,故a正确;
b.控制气流速率,宜慢不宜快,可提高反应物的利用率,增大产率,故b正确;
c.为放热反应,加热三颈烧瓶,平衡逆向移动,产率减小,故c错误;
d.正反应为放热反应,若三颈烧瓶发烫,可适当降温,使平衡正向移动,增大产率,故d正确;
故答案为:abd;
(5)反应后得到液体混合物互溶,沸点不同,可选蒸馏 (温度范围在69.1℃以上,100℃以下)分离出硫酰氯,
故答案为:蒸馏;
(6)SO2通入Fe2(SO4)3酸性溶液中,Fe3+能将SO2氧化为硫酸,发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++4H++SO42-,
故答案为:2Fe3++SO2+2H2O=2Fe2++4H++SO42-。
解析
步骤 1:仪器A的名称
仪器A为球形冷凝管,用于冷凝回流反应物和产物,防止挥发损失。
步骤 2:装置丙所装试剂
装置丙中利用饱和食盐水除去挥发的HCl,防止HCl进入后续反应装置。
步骤 3:若无装置乙对实验的影响
若无装置乙,将有水蒸气进入三颈烧瓶中,SO_2Cl_2水解生成HCl和H_2SO_4,影响实验结果。
步骤 4:仪器B所装试剂及作用
装置B的作用是吸收含有氯气和SO_2的尾气,防止污染环境,同时防止空气中的水进入三颈烧瓶,使SO_2Cl_2水解,应选择碱石灰。
步骤 5:提高硫酰氯产率的注意事项
a.先通冷凝水,再通气体,可提高反应物的利用率,增大产率。
b.控制气流速率,宜慢不宜快,可提高反应物的利用率,增大产率。
c.为放热反应,加热三颈烧瓶,平衡逆向移动,产率减小。
d.正反应为放热反应,若三颈烧瓶发烫,可适当降温,使平衡正向移动,增大产率。
步骤 6:从分解产物中分离出硫酰氯的方法
反应后得到液体混合物互溶,沸点不同,可选蒸馏(温度范围在69.1℃以上,100℃以下)分离出硫酰氯。
步骤 7:SO_2与Fe_2(SO_4)_3酸性溶液反应的离子方程式
SO_2通入Fe_2(SO_4)_3酸性溶液中,Fe^{3+}能将SO_2氧化为硫酸,发生反应的离子方程式为2Fe^{3+}+SO_2+2H_2O=2Fe^{2+}+4H^{+}+SO_4^{2-}。
仪器A为球形冷凝管,用于冷凝回流反应物和产物,防止挥发损失。
步骤 2:装置丙所装试剂
装置丙中利用饱和食盐水除去挥发的HCl,防止HCl进入后续反应装置。
步骤 3:若无装置乙对实验的影响
若无装置乙,将有水蒸气进入三颈烧瓶中,SO_2Cl_2水解生成HCl和H_2SO_4,影响实验结果。
步骤 4:仪器B所装试剂及作用
装置B的作用是吸收含有氯气和SO_2的尾气,防止污染环境,同时防止空气中的水进入三颈烧瓶,使SO_2Cl_2水解,应选择碱石灰。
步骤 5:提高硫酰氯产率的注意事项
a.先通冷凝水,再通气体,可提高反应物的利用率,增大产率。
b.控制气流速率,宜慢不宜快,可提高反应物的利用率,增大产率。
c.为放热反应,加热三颈烧瓶,平衡逆向移动,产率减小。
d.正反应为放热反应,若三颈烧瓶发烫,可适当降温,使平衡正向移动,增大产率。
步骤 6:从分解产物中分离出硫酰氯的方法
反应后得到液体混合物互溶,沸点不同,可选蒸馏(温度范围在69.1℃以上,100℃以下)分离出硫酰氯。
步骤 7:SO_2与Fe_2(SO_4)_3酸性溶液反应的离子方程式
SO_2通入Fe_2(SO_4)_3酸性溶液中,Fe^{3+}能将SO_2氧化为硫酸,发生反应的离子方程式为2Fe^{3+}+SO_2+2H_2O=2Fe^{2+}+4H^{+}+SO_4^{2-}。