题目
8.下列电池的电动势为0.413V,-|||-Pt, _(2)(100kPa)|HA(0.215molcdot (L)^-1,-|||-(0.116molcdot (L)^-1):SCE-|||-_(sg)=0.2443V, 计算弱酸HA的解离常数。

题目解答
答案
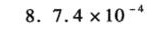
解析
步骤 1:确定电池的电动势
电池的电动势为0.413V,其中SCE(饱和甘汞电极)的电动势为0.2443V。因此,电池的电动势可以表示为:
\[ E_{cell} = E_{SCE} + E_{HA} \]
其中,$E_{HA}$是HA溶液相对于SCE的电动势。
步骤 2:计算HA溶液相对于SCE的电动势
根据题目给出的电池电动势和SCE的电动势,可以计算出HA溶液相对于SCE的电动势:
\[ E_{HA} = E_{cell} - E_{SCE} = 0.413V - 0.2443V = 0.1687V \]
步骤 3:利用Nernst方程计算HA的解离常数
根据Nernst方程,HA溶液相对于SCE的电动势可以表示为:
\[ E_{HA} = E_{HA}^{0} - \frac{RT}{nF} \ln \frac{[A^{-}]}{[HA]} \]
其中,$E_{HA}^{0}$是HA的标准电动势,$R$是气体常数,$T$是温度,$n$是电子转移数,$F$是法拉第常数,$[A^{-}]$是A-离子的浓度,$[HA]$是HA的浓度。
由于HA是弱酸,其解离常数$K_{a}$可以表示为:
\[ K_{a} = \frac{[H^{+}][A^{-}]}{[HA]} \]
由于HA的浓度远大于A-离子的浓度,可以近似认为$[H^{+}] = [A^{-}]$,因此:
\[ K_{a} = \frac{[A^{-}]^{2}}{[HA]} \]
将$[A^{-}] = 0.116mol\cdot L^{-1}$,$[HA] = 0.215mol\cdot L^{-1}$代入上式,可以计算出HA的解离常数$K_{a}$。
步骤 4:计算HA的解离常数
将步骤3中的数据代入,可以计算出HA的解离常数$K_{a}$:
\[ K_{a} = \frac{[A^{-}]^{2}}{[HA]} = \frac{(0.116)^{2}}{0.215} = 7.4\times 10^{-4} \]
电池的电动势为0.413V,其中SCE(饱和甘汞电极)的电动势为0.2443V。因此,电池的电动势可以表示为:
\[ E_{cell} = E_{SCE} + E_{HA} \]
其中,$E_{HA}$是HA溶液相对于SCE的电动势。
步骤 2:计算HA溶液相对于SCE的电动势
根据题目给出的电池电动势和SCE的电动势,可以计算出HA溶液相对于SCE的电动势:
\[ E_{HA} = E_{cell} - E_{SCE} = 0.413V - 0.2443V = 0.1687V \]
步骤 3:利用Nernst方程计算HA的解离常数
根据Nernst方程,HA溶液相对于SCE的电动势可以表示为:
\[ E_{HA} = E_{HA}^{0} - \frac{RT}{nF} \ln \frac{[A^{-}]}{[HA]} \]
其中,$E_{HA}^{0}$是HA的标准电动势,$R$是气体常数,$T$是温度,$n$是电子转移数,$F$是法拉第常数,$[A^{-}]$是A-离子的浓度,$[HA]$是HA的浓度。
由于HA是弱酸,其解离常数$K_{a}$可以表示为:
\[ K_{a} = \frac{[H^{+}][A^{-}]}{[HA]} \]
由于HA的浓度远大于A-离子的浓度,可以近似认为$[H^{+}] = [A^{-}]$,因此:
\[ K_{a} = \frac{[A^{-}]^{2}}{[HA]} \]
将$[A^{-}] = 0.116mol\cdot L^{-1}$,$[HA] = 0.215mol\cdot L^{-1}$代入上式,可以计算出HA的解离常数$K_{a}$。
步骤 4:计算HA的解离常数
将步骤3中的数据代入,可以计算出HA的解离常数$K_{a}$:
\[ K_{a} = \frac{[A^{-}]^{2}}{[HA]} = \frac{(0.116)^{2}}{0.215} = 7.4\times 10^{-4} \]