第10章 化学与材料典型试题及解析例10-1. 填空题(1) 三大合成材料是指 、 和 。(2) 聚氯乙烯、聚乙烯、聚苯乙烯等为 塑料,耐热性差,易变形;而酚醛塑料、氨基塑料、环氧树脂等都属于 塑料,耐热性好,不容易变形。(3) 天然橡胶的主要成分是 ;硅橡胶是 聚合物;氟橡胶是 的共聚物。(4) 橡胶分子链中存在 ,会被氧化而导致老化,往往要用 进行 处理,但应避免 ,使橡胶分子链 太多,减少甚至丧失弹性。(5) 冶金工业上把金属分为 金属和 金属两大类,前一类包括 ,后一类包括 。(6) 贮氢合金中,一种金属能 ,另一种金属与 ,第一种金属的作用是 ,第二种金属的作用是 。(7) 两性氧化物有 、 ;可作磨料的物质有 、 ;酸性耐火材料的主要成分为 ;中性耐火材料的主要成分为 ;可作盐浴剂的氯化物有 、 ;具有半导体性质的化合物有 ;目前临界温度最高的超导材料为 ;应用最多的气体激光材料为 。(8) 热固性塑料中产量最大的一个品种是 ,是以氨基化合物与 聚合而成的一类高分子化合物。脲醛塑料UF俗称 ,是由 与 为原料 而成的树脂。聚酰胺纤维俗称 。(9) 橡胶的分子链中存在 ,易被氧化;用 可以使橡胶分子链间适当发生 ,双键打开,形成网状结构,这样既减小被氧化的可能,又减少塑性变形,改善橡胶的性能。所以橡胶往往要进行 。
第10章 化学与材料
典型试题及解析
例10-1. 填空题
(1) 三大合成材料是指 、 和 。
(2) 聚氯乙烯、聚乙烯、聚苯乙烯等为 塑料,耐热性差,易变形;而酚醛塑料、氨基塑料、环氧树脂等都属于 塑料,耐热性好,不容易变形。
(3) 天然橡胶的主要成分是 ;硅橡胶是 聚合物;氟橡胶是 的共聚物。
(4) 橡胶分子链中存在 ,会被氧化而导致老化,往往要用 进行 处理,但应避免 ,使橡胶分子链 太多,减少甚至丧失弹性。
(5) 冶金工业上把金属分为 金属和 金属两大类,前一类包括 ,后一类包括 。
(6) 贮氢合金中,一种金属能 ,另一种金属与 ,第一种金属的作用是 ,第二种金属的作用是 。
(7) 两性氧化物有 、 ;可作磨料的物质有 、 ;酸性耐火材料的主要成分为 ;中性耐火材料的主要成分为 ;可作盐浴剂的氯化物有 、 ;具有半导体性质的化合物有 ;目前临界温度最高的超导材料为 ;应用最多的气体激光材料为 。
(8) 热固性塑料中产量最大的一个品种是 ,是以氨基化合物与 聚合而成的一类高分子化合物。脲醛塑料UF俗称 ,是由 与 为原料 而成的树脂。聚酰胺纤维俗称 。
(9) 橡胶的分子链中存在 ,易被氧化;用 可以使橡胶分子链间适当发生 ,双键打开,形成网状结构,这样既减小被氧化的可能,又减少塑性变形,改善橡胶的性能。所以橡胶往往要进行 。
题目解答
答案
解:(1) 塑料,合成纤维,合成橡胶
(2) 热塑性,热固性
(3) 聚异戊二烯,硅氧烷,偏氟乙烯
(4) 双键,硫黄等硫化剂,硫化,硫化过度,交联
(5) 黑色,有色,铁、锰、铬及其合金,除黑色金属以外的所有金属及其合金
(6) 大量吸进H2,氢的亲和力要小,控制H2的吸藏量,控制吸氢、放氢的可逆性。
(7) Al2O3,ZnO;Al2O3,Cr2O3;SiO2;Al2O3;NaCl,KCl;GaAs等ⅢA和ⅤA族化合物;Ca-Cu-Ba(Tc=123K);He-Ne
(8) 氨基塑料,甲醛,电玉,甲醛,尼龙(或Nylon)
(9) 双键,硫,胶连,硫化处理
例10-2. 试比较碱金属和铜族元素间的异同。
[分析] 本题应从原子结构上寻找答案。碱金属的价层电子构型为ns1(除1s1的H外),而铜族元素的价层电子构型为(n-1)d10ns1 (n>4),构型上的异同就决定了两族元素性质间的异同。
解:碱金属和铜族元素的相同处,是两族元素在一般情况下,都具有+1的氧化态。
不同处是:(1) 铜族元素的原子和离子半径要比相应的碱金属小(如第四周期中K的原子半径为203 pm,而Cu仅为117 pm),第一电离能则Cu比K大得多与 kJmol1之差)。
(2) 碱金属的活泼性是从上而下递增;而铜族元素则与此相反,从上而下递减(即铜最活泼,银、金相继次之)。
(3) 碱金属氧化数为+1,而铜族元素均有多种氧化数(如铜可有+1,+2;金有+1,+3等)。这是因为(n-1)d10上的部分电子亦可参与成键之故。
(4) 碱金属的化合物中的键型为离子键,而铜族元素化合物中则有相当程度的共价性。
(5) 铜族元素易形成配合物[如Cu(NH3)42+,Ag(S2O3)23和Au(CN)2等], 碱金属则较难。
例10-3. 下列各对金属最可能形成哪类合金举例说明。
(1) 具有相近的原子半径,相同的价电子数和同种晶格类型的金属之间。
(2) 原子的电负性相差很大,原子半径相差甚远的金属之间。
(3) 一金属和另一较小的非金属。
(4) 原子半径相差极大、电负性相近的金属之间。
[分析] 本题属于判断、分析合金类型。
解: (1) 生成取代固溶体。合金中可无序地分散着溶剂原子和溶质原子。例如Cu与Ni的合金,Cu与Ni有相近的原子半径,且均为面心立方晶格,彼此可完全溶解。
(2) 金属化合物合金。有较大的电负性差值所决定,例如MgCu2和Mg2Pb等。
(3) 间隙固溶体合金。溶剂原子占有晶格所有位置,故溶质原子只能占其间隙,因此它们的半径都必须较小方可,如C、B、N和H等元素。C溶入 Fe中形成的间充固溶体称为奥氏体。
(4) 低熔点合金。电负性相近而半径差大导致两金属间只能有限地溶解,以致晶体可在固化时分离。Pb和Sn形成的就是低熔点合金。
例10-4. 简述钛合金的优缺点。
解: 钛合金的优点很多,以至人们称之为“第四代金属”(继青铜、钢铁和铝等前三代金属之后)或“未来的金属”。
(1) 钛及钛合金密度小,强度高,故其“比强度”(强度与密度之比)是目前所有工业金属中最高的。
(2) 有突出的耐蚀性,与金、银等贵金属相近。这是因为钛合金有优异的钝化性能,即在其表面会有一层薄而致密、牢固的氧化膜生成,且在受到破坏后可自行修复。
(3) 液态的钛几乎可溶解所有的金属,形成固溶体或金属化合物等合金。若干合金元素(如Al、V、Zr等)的加入,可很好地改善钛的使用性能。例如体TiAlV合金为代表的超塑性合金,其最大伸长可达2000%,而一般合金塑性加工的伸长率最大不超过30%。
由于上述优异特性,钛和钛合金在工业和国防部门中获得广泛的应用。例如,火箭、导弹、航天飞机、船舶和化工部门中的耐蚀容器的材料等,都要用到钛和钛合金。
缺点是:(1) 冶炼困难,限制了钛和钛合金的进一步的应用;(2) 少量的杂质,特别是氧(在钛和钛合金内部以氧化物形式存在)、氮、碳等杂质存在时会降低其塑性,增加脆性。
平衡时物质的量/mol 11×80%
则平衡时总物质的量为 mol,由平衡常数Kp表达式得:
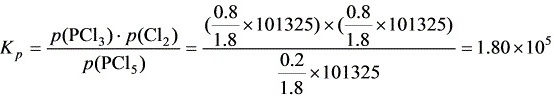
例2-13. 苯甲醇脱氢可用来生产香料苯甲醛。
反应:C6H5CH2OH (g) ⇌ C6H5CHO(g) + H2(g),523 K时,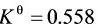 ,
,
(1) 假若将1.20 g苯甲醇放在 2.00 L容器中并加热至523 K,当平衡时苯甲醛的分压是多少
(2) 平衡时苯甲醇的分解率是多少
解: (1) M(C6H5CH2OH)=
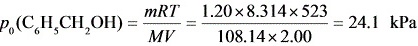
C6H5CH2OH (g) ⇌ C6H5CHO(g) + H2(g)
平衡时p /kPa x x x
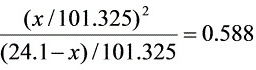
∴x =
p(C6H5CHO)= kPa
(2) 苯甲醇的分解率 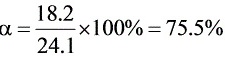
试题