题目
26.298K时,测得下列电池的电动势 E=1.136V-|||-|AgCl(s)|HCl(aq)|(Cl)_(2)(p)p|pt-|||-在此温度下,已知 _({Cl)_(2)}(||)^-=1.358V, _(Ag)+(A)_(8)=0.799V 请计算AgCl(s )的标准摩尔生成-|||-Gibbs自由能 (Delta )_(1)(G)_(m) 和标准活度积常数K
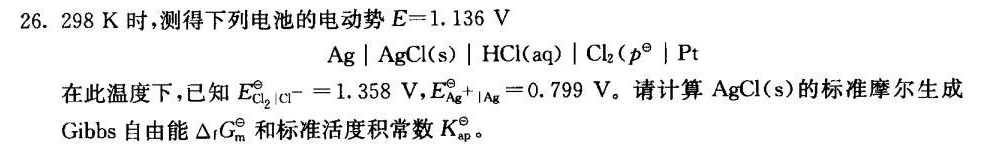
题目解答
答案
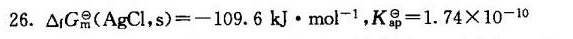
解析
步骤 1:确定电池反应
电池反应为:$Ag(s) + Cl_2(g) \rightarrow AgCl(s) + Cl^-(aq)$
步骤 2:计算电池的电动势
根据给定的电动势 $E = 1.136V$,以及标准电极电势 ${E}_{{Cl}_{2}}{||}^{-}=1.358V$ 和 ${E}_{Ag}+{A}_{8}=0.799V$,可以计算电池的电动势。
步骤 3:计算标准摩尔生成 Gibbs自由能
根据公式 $\Delta G^\theta = -nFE$,其中 $n$ 为电子转移数,$F$ 为法拉第常数,$E$ 为电池电动势,可以计算标准摩尔生成 Gibbs自由能。
步骤 4:计算标准活度积常数
根据公式 $\Delta G^\theta = -RT\ln K$,其中 $R$ 为气体常数,$T$ 为温度,$K$ 为标准活度积常数,可以计算标准活度积常数。
电池反应为:$Ag(s) + Cl_2(g) \rightarrow AgCl(s) + Cl^-(aq)$
步骤 2:计算电池的电动势
根据给定的电动势 $E = 1.136V$,以及标准电极电势 ${E}_{{Cl}_{2}}{||}^{-}=1.358V$ 和 ${E}_{Ag}+{A}_{8}=0.799V$,可以计算电池的电动势。
步骤 3:计算标准摩尔生成 Gibbs自由能
根据公式 $\Delta G^\theta = -nFE$,其中 $n$ 为电子转移数,$F$ 为法拉第常数,$E$ 为电池电动势,可以计算标准摩尔生成 Gibbs自由能。
步骤 4:计算标准活度积常数
根据公式 $\Delta G^\theta = -RT\ln K$,其中 $R$ 为气体常数,$T$ 为温度,$K$ 为标准活度积常数,可以计算标准活度积常数。