题目
2.用 .10mol/L HCl 滴定20.00ml同浓度的CH3NH2溶液(CH3NH 2的 (K)_(b)=3.38 )。-|||-(1)写出滴定反应方程式;(2)计算化学计量点的pH并指出应选用的指示剂;(3)若滴定-|||-到pH4为终点,计算终点误差。

题目解答
答案
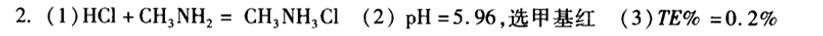
解析
步骤 1:滴定反应方程式
滴定反应是酸碱中和反应,$HCl$ 与 $CH_{3}NH_{2}$ 反应生成 $CH_{3}NH_{3}Cl$ 和 $H_{2}O$。
步骤 2:计算化学计量点的pH
化学计量点时,$HCl$ 和 $CH_{3}NH_{2}$ 的物质的量相等,生成的 $CH_{3}NH_{3}Cl$ 溶液中,$CH_{3}NH_{3}^{+}$ 的水解反应为:$CH_{3}NH_{3}^{+} + H_{2}O \rightleftharpoons CH_{3}NH_{2} + H_{3}O^{+}$。根据 $pK_{b}$ 计算 $pK_{a}$,再计算 $pH$。
步骤 3:选择指示剂
根据计算出的 $pH$ 值,选择合适的指示剂。
步骤 4:计算终点误差
根据滴定终点的 $pH$ 值,计算终点误差。
滴定反应是酸碱中和反应,$HCl$ 与 $CH_{3}NH_{2}$ 反应生成 $CH_{3}NH_{3}Cl$ 和 $H_{2}O$。
步骤 2:计算化学计量点的pH
化学计量点时,$HCl$ 和 $CH_{3}NH_{2}$ 的物质的量相等,生成的 $CH_{3}NH_{3}Cl$ 溶液中,$CH_{3}NH_{3}^{+}$ 的水解反应为:$CH_{3}NH_{3}^{+} + H_{2}O \rightleftharpoons CH_{3}NH_{2} + H_{3}O^{+}$。根据 $pK_{b}$ 计算 $pK_{a}$,再计算 $pH$。
步骤 3:选择指示剂
根据计算出的 $pH$ 值,选择合适的指示剂。
步骤 4:计算终点误差
根据滴定终点的 $pH$ 值,计算终点误差。