rm(()一rm()) rm(()Ⅰrm()50mL0.5mol·L^-1)的盐酸与rm(50mL0.55mol·L^-1)的rm(NaOH)溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: 环形玻璃搅拌棒-|||-温度计-|||-5-|||-碎泡沫塑料+ rm((1))在测定中和热的实验中,计算反应热时需要的数据有_________。 rm(①)酸的浓度和体积 rm(②)碱的浓度和体积 rm(③)比热容 rm(④)反应前后溶液的温度差 rm(⑤)操作所需时间 A.rm(①②③⑤) rm(B.①②③④) C.rm(②③④⑤) rm(D.①③④⑤) rm((2))实验中改用rm(60mL0.50mol·L^-1)的盐酸跟rm(50mL0.55mol·L^-1)的rm(NaOH)溶液进行反应,与上述实验相比,所求中和热_________rm(()填“相等”或“不相等”rm()),所放出的热量________rm(()填“相等”或“不相等”rm())。 rm((3))用相同浓度和体积的氨水代替rm(NaOH)溶液进行上述实验,测得的中和热数值会______rm(()填“偏大”、“偏小”或“无影响”rm()). rm(()Ⅱrm()) rm((4))化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成rm(()或拆开rm()1mol)化学键时释放rm(()或吸收rm())的能量,已知白磷和rm(P_{4)O_(6)} 的分子结构如下图所示,现提供以下化学键的键能:rm(P-P) :rm(198) rm(kJ·mol^-1),rm(P-O) :rm(360) rm(kJ·mol^-1),rm(O=O) :rm(498) rm(kJ·mol^-1),则反应rm(P_{4)(}白磷rm() +3O_{2)=P_(4)O_(6)}的热化学反应方程式为______________________。 环形玻璃搅拌棒-|||-温度计-|||-5-|||-碎泡沫塑料+ rm((5))肼rm((N_{2)H_(4))}可作为火箭发动机的燃料,与氧化剂rm(N_{2)O_(4)}反应生成rm(N_{2)}和水蒸气。 已知:rm(①N_{2)(g)+2O_(2)(g)═N_(2)O_(4)(l)} rm(triangle H_{1)=-19.5kJ·mol^-1} rm(②N_{2)H_(4)(l)+O_(2)(g)═N_(2)(g)+2H_(2)O(g) triangle H_(2)=-534.2kJ·mol^-1} 写出肼和rm(N_{2)O_(4)}反应的热化学方程式_______________________ 。 rm(()二rm()) rm(t ℃) 时,将rm(2 mol SO_{2)}和rm(1 mol O_{2)}通入体积为rm(2 L)的恒温恒容密闭容器中,发生反应:rm(2SO_{2)(g) +O_(2)(g)⇌ 2SO_(3)(g)} rm(ΔH=-196 kJ/mol)。rm(2 min) 时反应达到化学平衡,此时测得反应放出的热量为rm(39.2 kJ)。请填写下列空白: rm((1))下列叙述能证明该反应已经达到化学平衡状态的是________rm(()填标号,下同rm())。 A.容器内压强不再发生变化 B.rm(SO_{2)}的体积分数不再发生变化 C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化 rm((2))从反应开始至达到化学平衡,生成rm(SO_{3)}平均反应速率为____________;该条件下反应的平衡常数rm(K=)________rm(()精确到小数点后两位rm())。 rm((3))反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高rm(SO_{2)}转化率的是________。 A.向容器中通入少量rm(O_{2)} rm(B.)向容器中通入少量rm(SO_{2)} C.使用催化剂 rm(D.)降低温度 E.向容器中通入少量氦气 rm((4))上述反应达平衡后,再通入rm(1.6 mol SO_{2)}、rm(0.8 mol O_{2)}、rm(0.4 mol SO_{3)} ,则平衡________移动。rm(()填“向右”、“向左”或“不”rm()) rm(()三rm()) 高温下,炼铁高炉中存在下列平衡:rm(FeO(s)+CO(g)⇌ Fe(s)+CO_{2)(g)triangle H > 0}。试回答下列问题: rm((1))写出该反应的平衡常数表达式_____________. rm((2))升高温度,该反应的平衡常数rm(K)值将________rm(()填“增大”、“减小”、“不变”rm()),平衡体系中固体的质量将________rm(() 填“增大”、“减小”、“不变”rm()). rm((3))已知rm(1100℃)时该反应的平衡常数rm(K=0.263.)在该温度测得高炉中rm(c(CO_{2))=0.025mol·L^-1},rm(c(CO)=0.1mol·L^-1),此时该的化学反应速度是rm(v()正rm())____rm( ()填“rm( > )”、“rm( < )”、“rm(=)”rm()v()逆rm()). rm((4))保持高炉温度为rm(1100℃),向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数rm(K)值_______rm(()填”rm( > )”、“rm( < )”、“rm(=)”rm()0.263). rm(()四rm()) rm(25℃)下,现有rm(0.1mol·L^-1)的rm(H_{2)SO_(4)}和rm(0.1 mol·L^-1)一元弱酸rm(HA)两种溶液。 rm((1))实验测得rm(0.1 mol·L^-1)一元弱酸rm(HA) 的rm(pH)为rm(4),则rm(HA)的电离平衡常数rm(Ka=)____。 rm((2)0.1mol·L^-1)的rm(H_{2)SO_(4)}中水电离出的rm(C(H^+))为___________。 rm((3))向rm(0.1mol·L^-1)的硫酸中加入一定体积的rm(pH=13)的rm(NaOH)溶液,反应后溶液的rm(pH)为rm(2),则所需rm(NaOH)溶液与硫酸的体积比为________; rm((4))向rm(0.1 mol·L^-1)一元弱酸rm(HA)加入一定体积的水,在此过程中,下列数值变大的是__。 rm(①c(H^+)) rm(②) 电离度rm((α)) rm(③c(OH^-)) rm(④ Ka) rm(⑤c(A^-)/ c(HA)) rm(⑥n(A^-)) rm(()五rm()) 某同学用中和滴定法测定某烧碱的纯度,实验过程如下: rm((1))配制待测液:称取rm(6.0 g)固体烧碱样品rm(()杂质不与酸反应rm())配制成rm(250 mL)溶液。 rm((2))滴定: rm(①)用_______量取rm(15.00 ml.)待测液。 rm(②)向锥形瓶中加入几滴甲基橙,用rm(0.2010 mol ·L^-1)的标准硫酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,滴定终点时的现象为_______________________。 rm((3))数据处理 实验次 序编号 硫酸溶液体积 rm(V/mL) 氢氧化钠溶液体积 rm(V/mL) rm(1) rm(19.90) rm(15.00) rm(2) rm(20.10) rm(15.00) rm(3) rm(22.00) rm(15.00) rm(4) rm(20.00) rm(15.00) 根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为______,碱的纯度为_______rm(()保留两位小数rm())。 rm((4)—)定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的rm(NaOH)溶液。下列有关说法中正确的是__________________rm(()多选rm())。 A.实验中所用到的滴定管、容量瓶,在使用前均需要验漏 B.如果实验中需用rm(80 mL)的稀盐酸标准溶液,配制时应选用rm(100mL)容量瓶 C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的rm(NaOH)溶液的浓度将偏小 E.配制标准溶液时,定容时俯视读数,则导致滴定时测得的rm(NaOH)溶液的浓度偏大 F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏小 G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小 H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大 I.在滴定过程中,不慎将数滴酸液滴在锥形瓶外,则导致实验结果偏大
$\rm{(}$一$\rm{)}$
$\rm{(}$Ⅰ$\rm{)50mL0.5mol·L^{-1}}$的盐酸与$\rm{50mL0.55mol·L^{-1}}$的$\rm{NaOH}$溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
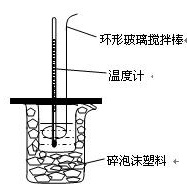
$\rm{(1)}$在测定中和热的实验中,计算反应热时需要的数据有_________。
$\rm{①}$酸的浓度和体积 $\rm{②}$碱的浓度和体积 $\rm{③}$比热容
$\rm{④}$反应前后溶液的温度差 $\rm{⑤}$操作所需时间
A.$\rm{①②③⑤}$ $\rm{B.①②③④}$
C.$\rm{②③④⑤}$ $\rm{D.①③④⑤}$
$\rm{(2)}$实验中改用$\rm{60mL0.50mol·L^{-1}}$的盐酸跟$\rm{50mL0.55mol·L^{-1}}$的$\rm{NaOH}$溶液进行反应,与上述实验相比,所求中和热_________$\rm{(}$填“相等”或“不相等”$\rm{)}$,所放出的热量________$\rm{(}$填“相等”或“不相等”$\rm{)}$。
$\rm{(3)}$用相同浓度和体积的氨水代替$\rm{NaOH}$溶液进行上述实验,测得的中和热数值会______$\rm{(}$填“偏大”、“偏小”或“无影响”$\rm{)}$.
$\rm{(}$Ⅱ$\rm{)}$
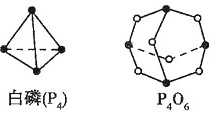
$\rm{(4)}$化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成$\rm{(}$或拆开$\rm{)1mol}$化学键时释放$\rm{(}$或吸收$\rm{)}$的能量,已知白磷和$\rm{P_{4}O_{6}}$ 的分子结构如下图所示,现提供以下化学键的键能:$\rm{P-P}$ :$\rm{198}$ $\rm{kJ·mol^{-1}}$,$\rm{P-O}$ :$\rm{360}$ $\rm{kJ·mol^{-1}}$,$\rm{O=O}$ :$\rm{498}$ $\rm{kJ·mol^{-1}}$,则反应$\rm{P_{4}(}$白磷$\rm{) +3O_{2}=P_{4}O_{6}}$的热化学反应方程式为______________________。
$\rm{(5)}$肼$\rm{(N_{2}H_{4})}$可作为火箭发动机的燃料,与氧化剂$\rm{N_{2}O_{4}}$反应生成$\rm{N_{2}}$和水蒸气。
已知:$\rm{①N_{2}(g)+2O_{2}(g)═N_{2}O_{4}(l)}$ $\rm{\triangle H_{1}=-19.5kJ·mol^{-1}}$
$\rm{②N_{2}H_{4}(l)+O_{2}(g)═N_{2}(g)+2H_{2}O(g) \triangle H_{2}=-534.2kJ·mol^{-1}}$
写出肼和$\rm{N_{2}O_{4}}$反应的热化学方程式_______________________ 。
$\rm{(}$二$\rm{)}$
$\rm{t ℃}$ 时,将$\rm{2 mol SO_{2}}$和$\rm{1 mol O_{2}}$通入体积为$\rm{2 L}$的恒温恒容密闭容器中,发生反应:$\rm{2SO_{2}(g) +O_{2}(g)⇌ 2SO_{3}(g)}$ $\rm{ΔH=-196 kJ/mol}$。$\rm{2 min}$ 时反应达到化学平衡,此时测得反应放出的热量为$\rm{39.2 kJ}$。请填写下列空白:
$\rm{(1)}$下列叙述能证明该反应已经达到化学平衡状态的是________$\rm{(}$填标号,下同$\rm{)}$。
A.容器内压强不再发生变化
B.$\rm{SO_{2}}$的体积分数不再发生变化
C.容器内气体质量不再发生变化
D.容器内气体密度不再发生变化
$\rm{(2)}$从反应开始至达到化学平衡,生成$\rm{SO_{3}}$平均反应速率为____________;该条件下反应的平衡常数$\rm{K=}$________$\rm{(}$精确到小数点后两位$\rm{)}$。
$\rm{(3)}$反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高$\rm{SO_{2}}$转化率的是________。
A.向容器中通入少量$\rm{O_{2}}$ $\rm{B.}$向容器中通入少量$\rm{SO_{2}}$
C.使用催化剂 $\rm{D.}$降低温度
E.向容器中通入少量氦气
$\rm{(4)}$上述反应达平衡后,再通入$\rm{1.6 mol SO_{2}}$、$\rm{0.8 mol O_{2}}$、$\rm{0.4 mol SO_{3}}$ ,则平衡________移动。$\rm{(}$填“向右”、“向左”或“不”$\rm{)}$
$\rm{(}$三$\rm{)}$
高温下,炼铁高炉中存在下列平衡:$\rm{FeO(s)+CO(g)⇌ Fe(s)+CO_{2}(g)\triangle H > 0}$。试回答下列问题:
$\rm{(1)}$写出该反应的平衡常数表达式_____________.
$\rm{(2)}$升高温度,该反应的平衡常数$\rm{K}$值将________$\rm{(}$填“增大”、“减小”、“不变”$\rm{)}$,平衡体系中固体的质量将________$\rm{(}$ 填“增大”、“减小”、“不变”$\rm{)}$.
$\rm{(3)}$已知$\rm{1100℃}$时该反应的平衡常数$\rm{K=0.263.}$在该温度测得高炉中$\rm{c(CO_{2})=0.025mol·L^{-1}}$,$\rm{c(CO)=0.1mol·L^{-1}}$,此时该的化学反应速度是$\rm{v(}$正$\rm{)}$____$\rm{ (}$填“$\rm{ > }$”、“$\rm{ < }$”、“$\rm{=}$”$\rm{)v(}$逆$\rm{)}$.
$\rm{(4)}$保持高炉温度为$\rm{1100℃}$,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数$\rm{K}$值_______$\rm{(}$填”$\rm{ > }$”、“$\rm{ < }$”、“$\rm{=}$”$\rm{)0.263}$.
$\rm{(}$四$\rm{)}$
$\rm{25℃}$下,现有$\rm{0.1mol·L^{-1}}$的$\rm{H_{2}SO_{4}}$和$\rm{0.1 mol·L^{-1}}$一元弱酸$\rm{HA}$两种溶液。
$\rm{(1)}$实验测得$\rm{0.1 mol·L^{-1}}$一元弱酸$\rm{HA}$ 的$\rm{pH}$为$\rm{4}$,则$\rm{HA}$的电离平衡常数$\rm{Ka=}$____。
$\rm{(2)0.1mol·L^{-1}}$的$\rm{H_{2}SO_{4}}$中水电离出的$\rm{C(H^{+})}$为___________。
$\rm{(3)}$向$\rm{0.1mol·L^{-1}}$的硫酸中加入一定体积的$\rm{pH=13}$的$\rm{NaOH}$溶液,反应后溶液的$\rm{pH}$为$\rm{2}$,则所需$\rm{NaOH}$溶液与硫酸的体积比为________;
$\rm{(4)}$向$\rm{0.1 mol·L^{-1}}$一元弱酸$\rm{HA}$加入一定体积的水,在此过程中,下列数值变大的是__。
$\rm{①c(H^{+})}$ $\rm{②}$ 电离度$\rm{(α)}$
$\rm{③c(OH^{-})}$ $\rm{④ Ka}$
$\rm{⑤c(A^{-})/ c(HA)}$ $\rm{⑥n(A^{-})}$
$\rm{(}$五$\rm{)}$
某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
$\rm{(1)}$配制待测液:称取$\rm{6.0 g}$固体烧碱样品$\rm{(}$杂质不与酸反应$\rm{)}$配制成$\rm{250 mL}$溶液。
$\rm{(2)}$滴定:
$\rm{①}$用_______量取$\rm{15.00 ml.}$待测液。
$\rm{②}$向锥形瓶中加入几滴甲基橙,用$\rm{0.2010 mol ·L^{-1}}$的标准硫酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,滴定终点时的现象为_______________________。
$\rm{(3)}$数据处理
实验次 序编号 | 硫酸溶液体积 $\rm{V/mL}$ | 氢氧化钠溶液体积 $\rm{V/mL}$ |
$\rm{1}$ | $\rm{19.90}$ | $\rm{15.00}$ |
$\rm{2}$ | $\rm{20.10}$ | $\rm{15.00}$ |
$\rm{3}$ | $\rm{22.00}$ | $\rm{15.00}$ |
$\rm{4}$ | $\rm{20.00}$ | $\rm{15.00}$ |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为______,碱的纯度为_______$\rm{(}$保留两位小数$\rm{)}$。
$\rm{(4)—}$定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的$\rm{NaOH}$溶液。下列有关说法中正确的是__________________$\rm{(}$多选$\rm{)}$。
A.实验中所用到的滴定管、容量瓶,在使用前均需要验漏
B.如果实验中需用$\rm{80 mL}$的稀盐酸标准溶液,配制时应选用$\rm{100mL}$容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的$\rm{NaOH}$溶液的浓度将偏小
E.配制标准溶液时,定容时俯视读数,则导致滴定时测得的$\rm{NaOH}$溶液的浓度偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏小
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
I.在滴定过程中,不慎将数滴酸液滴在锥形瓶外,则导致实验结果偏大
题目解答
答案
$\rm{(}$一$\rm{)}$
$\rm{(}$Ⅰ$\rm{)(1)B}$
$\rm{(2)}$不等 ; 相等
$\rm{(3)}$偏小
$\rm{(}$Ⅱ$\rm{)(4)P_{4}(}$白磷 $\rm{s)+3O_{2}(g)=P_{4}O_{6}}$ $\rm{(s)}$ $\rm{\triangle H=—1638kJ·mol^{-1}}$
$\rm{(5)2N_{2}H_{4}(l)+N_{2}O_{4}(l)=3N_{2}(g)+4H_{2}O(g)}$ $\rm{\triangle H=-1048.9kJ/mol}$
$\rm{(}$二$\rm{)}$
$\rm{(1)A}$、$\rm{B}$ $\rm{(2)0.1 mol/(L·min)}$ , $\rm{0.16}$ $\rm{(3)A}$、$\rm{D}$ $\rm{(4)}$向右
$\rm{(}$三$\rm{)}$
$\rm{(1)}$![]() ;$\rm{(2)}$增大;减小;$\rm{(3) > }$; $\rm{(4)=}$.
;$\rm{(2)}$增大;减小;$\rm{(3) > }$; $\rm{(4)=}$.
$\rm{(}$四$\rm{)}$
$\rm{(1)1.0×10^{-7\;}mol}$ $\rm{·L-1}$ $\rm{(2)5.0×10^{-14}mol}$ $\rm{·L^{-1}}$
$\rm{(3)19:11}$ $\rm{(4)②③⑤⑥}$
$\rm{(}$五$\rm{)}$
$\rm{(2)①}$碱式滴定管 ; $\rm{②}$当滴入最后一滴标准液时,溶液恰好由黄色变为橙色,且半分钟内不变色
$\rm{(3)0.5360 mol/L}$; $\rm{89.33\%}$
$\rm{(4)ABFHI}$