题目
有“退热冰”之称的乙酰苯胺 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺( )和乙酸反应(该反应是放热反应)制得。 已知: 1.苯胺在空气中易被氧化。 2.可能用到的有关性质如下: 名称 相对分子质量 性状 密度/g∙cm3 熔点/℃ 沸点/℃ 溶解度 g/100g水 g/100g乙醇 苯胺 93 棕黄色油状液体 1.02 -6.3 184 微溶 ∞ 冰醋酸 60 无色透明液体 1.05 16.6 117.9 ∞ ∞ 乙酰苯胺 135 无色片状晶体 1.21 155~156 280~290 温度高,溶解度大 较水中大 Ⅰ.制备乙酰苯胺的实验步骤如下: 步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。 步骤2:小火加热回流1h。 步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。 请回答下列问题: (1)写出制备乙酰苯胺的化学方程式 ___ 。 (2)将三种试剂混合时,最后加入的试剂是 ___ ,这样做的原因是: ___ 。 (3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题: ①b处使用的仪器为 ___ (填“A”或“B”),该仪器的名称是 ___ 。 ②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是 ___ 。 Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示: (4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是: ___ 。 (5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是 ___ 。(精确到小数点后1位) ②导致实际值低于理论值的原因可能是 ___ (填字母标号)。 A.没有等充分冷却就开始过滤 B.抽滤后没有把滤液合并在一起 C.乙酰苯胺中的乙酸未除干净
有“退热冰”之称的乙酰苯胺 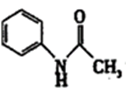 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(
具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺( 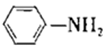 )和乙酸反应(该反应是放热反应)制得。
)和乙酸反应(该反应是放热反应)制得。
已知:
1.苯胺在空气中易被氧化。
2.可能用到的有关性质如下:
Ⅰ.制备乙酰苯胺的实验步骤如下:
步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。
步骤2:小火加热回流1h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。
请回答下列问题:
(1)写出制备乙酰苯胺的化学方程式 ___ 。
(2)将三种试剂混合时,最后加入的试剂是 ___ ,这样做的原因是: ___ 。
(3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题:
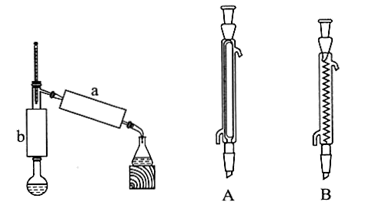
①b处使用的仪器为 ___ (填“A”或“B”),该仪器的名称是 ___ 。
②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是 ___ 。
Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:
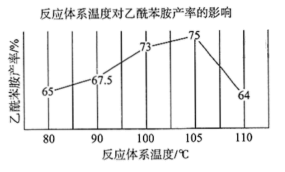
(4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是: ___ 。
(5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是 ___ 。(精确到小数点后1位)
②导致实际值低于理论值的原因可能是 ___ (填字母标号)。
A.没有等充分冷却就开始过滤
B.抽滤后没有把滤液合并在一起
C.乙酰苯胺中的乙酸未除干净
 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(
具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺( 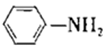 )和乙酸反应(该反应是放热反应)制得。
)和乙酸反应(该反应是放热反应)制得。 已知:
1.苯胺在空气中易被氧化。
2.可能用到的有关性质如下:
| 名称 | 相对分子质量 | 性状 | 密度/g∙cm3 | 熔点/℃ | 沸点/℃ | 溶解度 | |
| g/100g水 | g/100g乙醇 | ||||||
| 苯胺 | 93 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
| 冰醋酸 | 60 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
| 乙酰苯胺 | 135 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。
步骤2:小火加热回流1h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。
请回答下列问题:
(1)写出制备乙酰苯胺的化学方程式
(2)将三种试剂混合时,最后加入的试剂是
(3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题:

①b处使用的仪器为
②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是
Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:

(4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是:
(5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是
②导致实际值低于理论值的原因可能是
A.没有等充分冷却就开始过滤
B.抽滤后没有把滤液合并在一起
C.乙酰苯胺中的乙酸未除干净
题目解答
答案
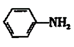 +CH3COOH
+CH3COOH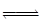
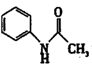 +H2O 苯胺 锌粉与醋酸反应生成氢气,可以排出装置中的空气,保护苯胺不被氧化 B 球形冷凝管 重结晶 温度高于100℃后,不断分离出反应过程中的水,促进反应正向进行,提高生成物的产率 79.3% AB
+H2O 苯胺 锌粉与醋酸反应生成氢气,可以排出装置中的空气,保护苯胺不被氧化 B 球形冷凝管 重结晶 温度高于100℃后,不断分离出反应过程中的水,促进反应正向进行,提高生成物的产率 79.3% AB解析
步骤 1:写出制备乙酰苯胺的化学方程式
苯胺和冰醋酸反应生成乙酰苯胺和水,化学方程式为:$HN-+CH_3COOH\rightarrow CH_3CO-NH_2+H_2O$。
步骤 2:确定最后加入的试剂
由于锌粉与醋酸反应生成氢气,可以排出装置中的空气,保护苯胺不被氧化,因此最后加入的试剂是苯胺。
步骤 3:确定b处使用的仪器
b处使用的仪器为B,该仪器的名称是球形冷凝管,用于回流反应。
步骤 4:确定粗乙酰苯胺固体的提纯方法
得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是重结晶。
步骤 5:分析反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因
温度高于100℃后,不断分离出反应过程中的水,促进反应正向进行,提高生成物的产率。
步骤 6:计算乙酰苯胺的产率
根据苯胺和冰醋酸的量,计算理论产量,然后根据实际产量计算产率。
步骤 7:分析导致实际值低于理论值的原因
A.没有等充分冷却就开始过滤,会导致部分乙酰苯胺溶解在滤液中,产率降低。
B.抽滤后没有把滤液合并在一起,会导致部分乙酰苯胺溶解在滤液中,产率降低。
C.乙酰苯胺中的乙酸未除干净,不会影响产率。
苯胺和冰醋酸反应生成乙酰苯胺和水,化学方程式为:$HN-+CH_3COOH\rightarrow CH_3CO-NH_2+H_2O$。
步骤 2:确定最后加入的试剂
由于锌粉与醋酸反应生成氢气,可以排出装置中的空气,保护苯胺不被氧化,因此最后加入的试剂是苯胺。
步骤 3:确定b处使用的仪器
b处使用的仪器为B,该仪器的名称是球形冷凝管,用于回流反应。
步骤 4:确定粗乙酰苯胺固体的提纯方法
得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是重结晶。
步骤 5:分析反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因
温度高于100℃后,不断分离出反应过程中的水,促进反应正向进行,提高生成物的产率。
步骤 6:计算乙酰苯胺的产率
根据苯胺和冰醋酸的量,计算理论产量,然后根据实际产量计算产率。
步骤 7:分析导致实际值低于理论值的原因
A.没有等充分冷却就开始过滤,会导致部分乙酰苯胺溶解在滤液中,产率降低。
B.抽滤后没有把滤液合并在一起,会导致部分乙酰苯胺溶解在滤液中,产率降低。
C.乙酰苯胺中的乙酸未除干净,不会影响产率。