题目
铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。钛白粉 蒸馏水、铁粉 精制 一定量氨水、空气 铁黄晶种 铁黄产品-|||-废渣 纯化 FeSO4溶液 制备晶种 FeOOH 制备铁黄 FeOOH资料:i.钛白粉废渣成分:主要为FeSO4•H2O,含少量TiOSO4和不溶物ii.TiOSO4+(x+1)H2O⇌TiO2•xH2O↓+H2SO4iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8(1)纯化充分反应后,分离混合物的方法是 ____ 。(2)制备晶种为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。钛白粉 蒸馏水、铁粉 精制 一定量氨水、空气 铁黄晶种 铁黄产品-|||-废渣 纯化 FeSO4溶液 制备晶种 FeOOH 制备铁黄 FeOOH①产生白色沉淀的离子方程式是 ____ 。②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+) ____ 0.1mol/L(填“>”“=”或“<”)。③0~t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因: ____ 。④pH≈4时制得铁黄晶种。(3)产品纯度测定酚酞NaOH标准溶液加热溶解H2SO4标准溶液Na2C2O4溶液铁黄纯度可以通过产品的耗酸量确定。wg铁黄溶液b溶液c滴定资料:Fe3++3C2(O)_(4)^2-═Fe(C2O4)33-,Fe(C2O4)33-不与稀碱液反应Na2C2O4过量,会使测定结果 ____ (填“偏大”“偏小”或“不受影响”)。铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。钛白粉 蒸馏水、铁粉 精制 一定量氨水、空气 铁黄晶种 铁黄产品-|||-废渣 纯化 FeSO4溶液 制备晶种 FeOOH 制备铁黄 FeOOH资料:i.钛白粉废渣成分:主要为FeSO4•H2O,含少量TiOSO4和不溶物ii.TiOSO4+(x+1)H2O⇌TiO2•xH2O↓+H2SO4iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8(1)纯化充分反应后,分离混合物的方法是 ____ 。(2)制备晶种为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。钛白粉 蒸馏水、铁粉 精制 一定量氨水、空气 铁黄晶种 铁黄产品-|||-废渣 纯化 FeSO4溶液 制备晶种 FeOOH 制备铁黄 FeOOH①产生白色沉淀的离子方程式是 ____ 。②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+) ____ 0.1mol/L(填“>”“=”或“<”)。③0~t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因: ____ 。④pH≈4时制得铁黄晶种。(3)产品纯度测定酚酞NaOH标准溶液加热溶解H2SO4标准溶液Na2C2O4溶液铁黄纯度可以通过产品的耗酸量确定。wg铁黄溶液b溶液c滴定资料:Fe3++3C2(O)_(4)^2-═Fe(C2O4)33-,Fe(C2O4)33-不与稀碱液反应Na2C2O4过量,会使测定结果 ____ (填“偏大”“偏小”或“不受影响”)。
铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。

资料:
i.钛白粉废渣成分:主要为FeSO4•H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2•xH2O↓+H2SO4
iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
充分反应后,分离混合物的方法是 ____ 。
(2)制备晶种
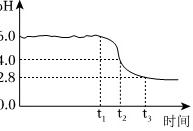
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。
①产生白色沉淀的离子方程式是 ____ 。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+) ____ 0.1mol/L(填“>”“=”或“<”)。
③0~t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因: ____ 。
④pH≈4时制得铁黄晶种。
(3)产品纯度测定
酚酞NaOH标准溶液
加热溶解H2SO4标准溶液
Na2C2O4溶液
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄溶液b溶液c滴定
资料:Fe3++3C2${O}_{4}^{2-}$═Fe(C2O4)33-,Fe(C2O4)33-不与稀碱液反应
Na2C2O4过量,会使测定结果 ____ (填“偏大”“偏小”或“不受影响”)。
铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。

资料:
i.钛白粉废渣成分:主要为FeSO4•H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2•xH2O↓+H2SO4
iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
充分反应后,分离混合物的方法是 ____ 。
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是 ____ 。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+) ____ 0.1mol/L(填“>”“=”或“<”)。
③0~t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因: ____ 。
④pH≈4时制得铁黄晶种。
(3)产品纯度测定
酚酞NaOH标准溶液
加热溶解H2SO4标准溶液
Na2C2O4溶液
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄溶液b溶液c滴定
资料:Fe3++3C2${O}_{4}^{2-}$═Fe(C2O4)33-,Fe(C2O4)33-不与稀碱液反应
Na2C2O4过量,会使测定结果 ____ (填“偏大”“偏小”或“不受影响”)。

资料:
i.钛白粉废渣成分:主要为FeSO4•H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2•xH2O↓+H2SO4
iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
充分反应后,分离混合物的方法是 ____ 。
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是 ____ 。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+) ____ 0.1mol/L(填“>”“=”或“<”)。
③0~t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因: ____ 。
④pH≈4时制得铁黄晶种。
(3)产品纯度测定
酚酞NaOH标准溶液
加热溶解H2SO4标准溶液
Na2C2O4溶液
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄溶液b溶液c滴定
资料:Fe3++3C2${O}_{4}^{2-}$═Fe(C2O4)33-,Fe(C2O4)33-不与稀碱液反应
Na2C2O4过量,会使测定结果 ____ (填“偏大”“偏小”或“不受影响”)。
铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。

资料:
i.钛白粉废渣成分:主要为FeSO4•H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2•xH2O↓+H2SO4
iii.0.1mol/LFe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1mol/LFe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
充分反应后,分离混合物的方法是 ____ 。
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。

①产生白色沉淀的离子方程式是 ____ 。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+) ____ 0.1mol/L(填“>”“=”或“<”)。
③0~t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因: ____ 。
④pH≈4时制得铁黄晶种。
(3)产品纯度测定
酚酞NaOH标准溶液
加热溶解H2SO4标准溶液
Na2C2O4溶液
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄溶液b溶液c滴定
资料:Fe3++3C2${O}_{4}^{2-}$═Fe(C2O4)33-,Fe(C2O4)33-不与稀碱液反应
Na2C2O4过量,会使测定结果 ____ (填“偏大”“偏小”或“不受影响”)。
题目解答
答案
解:(1)钛白粉废渣成分:FeSO4•H2O、TiOSO4及其它难溶物,充分反应后有沉淀出现,所以分离混合物的方法是过滤,
故答案为:过滤;
(2)①向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色,故白色沉淀为Fe(OH)2,产生方程式为Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$,
故答案为:Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$;
②产生白色沉淀后的pH低于资料ⅲ中的6.3,则氢氧根离子浓度小于理论数据,结合Ksp[Fe(OH)2]=c2(OH-)•c(Fe2+)可知,此时c(Fe2+)>0.1mol•L-1,
故答案为:>;
③分析可知,pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小,
故答案为:pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小;
(3)由于Fe3++3C2${O}_{4}^{2-}$=Fe(C2O4)3,Fe(C2O4)3 不与稀碱溶液反应,所以加入的Na2C2O4过量,则测定结果不受影响,
故答案为:不受影响。
解:(1)钛白粉废渣成分:FeSO4•H2O、TiOSO4及其它难溶物,充分反应后有沉淀出现,所以分离混合物的方法是过滤,
故答案为:过滤;
(2)①向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色,故白色沉淀为Fe(OH)2,产生方程式为Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$,
故答案为:Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$;
②产生白色沉淀后的pH低于资料ⅲ中的6.3,则氢氧根离子浓度小于理论数据,结合Ksp[Fe(OH)2]=c2(OH-)•c(Fe2+)可知,此时c(Fe2+)>0.1mol•L-1,
故答案为:>;
③分析可知,pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小,
故答案为:pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小;
(3)由于Fe3++3C2${O}_{4}^{2-}$=Fe(C2O4)3,Fe(C2O4)3 不与稀碱溶液反应,所以加入的Na2C2O4过量,则测定结果不受影响,
故答案为:不受影响。
故答案为:过滤;
(2)①向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色,故白色沉淀为Fe(OH)2,产生方程式为Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$,
故答案为:Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$;
②产生白色沉淀后的pH低于资料ⅲ中的6.3,则氢氧根离子浓度小于理论数据,结合Ksp[Fe(OH)2]=c2(OH-)•c(Fe2+)可知,此时c(Fe2+)>0.1mol•L-1,
故答案为:>;
③分析可知,pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小,
故答案为:pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小;
(3)由于Fe3++3C2${O}_{4}^{2-}$=Fe(C2O4)3,Fe(C2O4)3 不与稀碱溶液反应,所以加入的Na2C2O4过量,则测定结果不受影响,
故答案为:不受影响。
解:(1)钛白粉废渣成分:FeSO4•H2O、TiOSO4及其它难溶物,充分反应后有沉淀出现,所以分离混合物的方法是过滤,
故答案为:过滤;
(2)①向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色,故白色沉淀为Fe(OH)2,产生方程式为Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$,
故答案为:Fe2++2NH3•H2O=Fe(OH)2↓+2${NH}_{4}^{+}$;
②产生白色沉淀后的pH低于资料ⅲ中的6.3,则氢氧根离子浓度小于理论数据,结合Ksp[Fe(OH)2]=c2(OH-)•c(Fe2+)可知,此时c(Fe2+)>0.1mol•L-1,
故答案为:>;
③分析可知,pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小,
故答案为:pH=6.0左右,4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此pH几乎不变,之后发生4Fe2++O2+6H2O=4FeOOH+8H+,溶液中H+浓度增大,pH减小;
(3)由于Fe3++3C2${O}_{4}^{2-}$=Fe(C2O4)3,Fe(C2O4)3 不与稀碱溶液反应,所以加入的Na2C2O4过量,则测定结果不受影响,
故答案为:不受影响。