题目
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:下列有关该反应的叙述中正确的是( )表示钠原子 bigcirc 表示氯原子 O表示氧原子A.该反应是复分解反应B.该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaClC.反应中Cl2既是氧化剂,又是还原剂D.生成2 mol ClO2时转移的电子数为6 mol
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
下列有关该反应的叙述中正确的是( )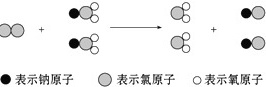
下列有关该反应的叙述中正确的是( )

- A.该反应是复分解反应
- B.该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
- C.反应中Cl2既是氧化剂,又是还原剂
- D.生成2 mol ClO2时转移的电子数为6 mol
题目解答
答案
【解答】解:A、由不同的小球代表的原子可知,反应物为氯气和NaClO2,氯气为单质,则该反应一定不是复分解反应,故A错误;
B、由三种小球表示的原子及微观过程可知,反应物为氯气和NaClO2,生成物为ClO2和NaCl,则反应为Cl2+2NaClO2═2ClO2+2NaCl,故B正确;
C、反应Cl2+2NaClO2═2ClO2+2NaCl中,Cl2中Cl元素的化合价降低,则Cl2为氧化剂,NaClO2中Cl元素的化合价升高,则NaClO2为还原剂,故C错误;
D、NaClO2中Cl元素的化合价由+3价升高到+4价,则生成2molClO2时转移的电子数为2mol×(4-3)=2mol,故D错误;
故选B.
B、由三种小球表示的原子及微观过程可知,反应物为氯气和NaClO2,生成物为ClO2和NaCl,则反应为Cl2+2NaClO2═2ClO2+2NaCl,故B正确;
C、反应Cl2+2NaClO2═2ClO2+2NaCl中,Cl2中Cl元素的化合价降低,则Cl2为氧化剂,NaClO2中Cl元素的化合价升高,则NaClO2为还原剂,故C错误;
D、NaClO2中Cl元素的化合价由+3价升高到+4价,则生成2molClO2时转移的电子数为2mol×(4-3)=2mol,故D错误;
故选B.
解析
步骤 1:分析反应物和生成物
根据题目中给出的微观过程,反应物为氯气(Cl_2)和亚氯酸钠(NaClO_2),生成物为二氧化氯(ClO_2)和氯化钠(NaCl)。
步骤 2:判断反应类型
由于反应物中包含单质(Cl_2),而复分解反应的定义是两种化合物相互交换成分生成另外两种化合物,因此该反应不是复分解反应。
步骤 3:写出化学方程式
根据反应物和生成物,可以写出化学方程式为:Cl_2 + 2NaClO_2 → 2ClO_2 + 2NaCl。
步骤 4:分析氧化还原反应
在反应Cl_2 + 2NaClO_2 → 2ClO_2 + 2NaCl中,Cl_2中的氯元素从0价变为ClO_2中的+4价,同时NaClO_2中的氯元素从+3价变为ClO_2中的+4价,因此Cl_2既是氧化剂(氧化NaClO_2中的氯元素)又是还原剂(被NaClO_2中的氯元素还原)。
步骤 5:计算电子转移数
在生成2 mol ClO_2的过程中,NaClO_2中的氯元素从+3价变为+4价,因此每生成1 mol ClO_2转移1 mol电子,生成2 mol ClO_2时转移的电子数为2 mol。
根据题目中给出的微观过程,反应物为氯气(Cl_2)和亚氯酸钠(NaClO_2),生成物为二氧化氯(ClO_2)和氯化钠(NaCl)。
步骤 2:判断反应类型
由于反应物中包含单质(Cl_2),而复分解反应的定义是两种化合物相互交换成分生成另外两种化合物,因此该反应不是复分解反应。
步骤 3:写出化学方程式
根据反应物和生成物,可以写出化学方程式为:Cl_2 + 2NaClO_2 → 2ClO_2 + 2NaCl。
步骤 4:分析氧化还原反应
在反应Cl_2 + 2NaClO_2 → 2ClO_2 + 2NaCl中,Cl_2中的氯元素从0价变为ClO_2中的+4价,同时NaClO_2中的氯元素从+3价变为ClO_2中的+4价,因此Cl_2既是氧化剂(氧化NaClO_2中的氯元素)又是还原剂(被NaClO_2中的氯元素还原)。
步骤 5:计算电子转移数
在生成2 mol ClO_2的过程中,NaClO_2中的氯元素从+3价变为+4价,因此每生成1 mol ClO_2转移1 mol电子,生成2 mol ClO_2时转移的电子数为2 mol。