19.已知下列反应各物质的 Delta t(F)_(m) 和S数,计算反应在298 K和373K时的K^-|||-(H)_(3)(aq)+(H)_(2)O(l)leftharpoons N(H)_(4)(aq)+(OH)^-(aq)-|||-Delta ([ {H)_(m)}^g/(kJcdot mo(l)^-1) -80.3 . -285.8 -132.5 -230.0-|||-_(m)/(1cdot (K)^-1cdot mo(L)^-1) 111.3 69.9 113.4 -10.75

题目解答
答案
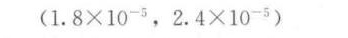
解析
本题考查化学平衡常数的计算,核心在于利用热力学数据(ΔH°和ΔS°)计算不同温度下的平衡常数K。解题关键点如下:
- 正确计算反应的ΔH°和ΔS°:通过各物质的标准摩尔生成焓(ΔHf°)和熵(S°)的差值计算。
- 应用吉布斯自由能公式:ΔG° = ΔH° - TΔS°,并结合ΔG°与平衡常数的关系式ΔG° = -RT ln K,推导K的值。
- 注意单位统一:ΔH°的单位需转换为焦耳(J),与熵的单位(J/(K·mol))保持一致。
1. 计算反应的ΔH°
反应式:
$\text{NH}_3(aq) + \text{H}_2\text{O}(l) \rightleftharpoons \text{NH}_4^+(aq) + \text{OH}^-(aq)$
根据公式:
$\Delta H^\circ = \sum \Delta H_f^\circ (\text{产物}) - \sum \Delta H_f^\circ (\text{反应物})$
代入数据:
$\Delta H^\circ = [(-132.5) + (-230.0)] - [(-80.3) + (-285.8)] = 3.6 \, \text{kJ/mol} = 3600 \, \text{J/mol}$
2. 计算反应的ΔS°
根据公式:
$\Delta S^\circ = \sum S^\circ (\text{产物}) - \sum S^\circ (\text{反应物})$
代入数据:
$\Delta S^\circ = [(113.4) + (-10.75)] - [(111.3) + (69.9)] = -78.55 \, \text{J/(K·mol)}$
3. 计算不同温度下的ΔG°和K
(1) 298 K时
$\Delta G^\circ = \Delta H^\circ - T\Delta S^\circ = 3600 - (298)(-78.55) = 27007.9 \, \text{J/mol}$
$\ln K = -\frac{\Delta G^\circ}{RT} = -\frac{27007.9}{8.314 \times 298} \approx -10.906$
$K = e^{-10.906} \approx 1.8 \times 10^{-5}$
(2) 373 K时
$\Delta G^\circ = 3600 - (373)(-78.55) = 32899.15 \, \text{J/mol}$
$\ln K = -\frac{32899.15}{8.314 \times 373} \approx -10.599$
$K = e^{-10.599} \approx 2.4 \times 10^{-5}$