富血铁的制备及含量测定(1)实验内容富马酸亚铁,商品名富血铁,含铁量高(33%),较难被氧化为三价铁,在胃内铁不直接游离,血清铁值很快上升,对胃粘膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂.①中间产品反丁烯二酸的制备:顺丁烯二酸肝溶于水,以硫脲为催化剂,加热制得反丁烯二酸(又称富马酸).②产品富马酸亚铁的制备:以反丁烯二酸为原料,在适当的(pH)条件下与(FeSO_{4)}反应得富马酸亚铁.③硫酸铈(Ⅳ)铵标准溶液的标定.④产品的分析:用硫酸铈(Ⅳ)法测定.⑤完成实验报告.(2)主要仪器、试剂及材料①主要仪器数显搅拌恒温电热套:1台; 可调电炉:1个布氏漏斗和抽滤瓶1套; 三口瓶(100)(mL):1个球形冷凝管:1支; 铁架台:2个量筒(100)(mL):1个,(10)(mL) 1个; 烧杯(400)(mL) :3个,(250)(mL):1个,(100)(mL) 2个;(50)(mL):1个酸式滴定管(50)(mL):1支; 称量瓶:1个锥形瓶(250)(mL) 3个; 滴定管夹:1只塑料洗瓶:1个; 洗耳球:1个玻棒:2支 搪瓷盘:1个角匙:1把 刮匙:1个表面皿:3只 培养皿:1只公用仪器:电子天平(最大称量200,pm (0.0001)(g)),电子天平(最大称量300,pm (0.01)(g)),移液管((25)(mL))②试剂及材料顺丁烯二酸酞:分析纯((AR)) 硫酸亚铁:分析纯((AR))({6)(mol/L) HCl}溶液 硫脲:分析纯((AR))碳酸钠:分析纯((AR)) 称量纸、滤纸硫酸亚铁铵标准溶液 (3)(mol/L);(H_{2)SO_(4)}溶液(浓度见公布值)({0.1)(mol/L) BaCl_(2)}溶液 硫酸铈(Ⅳ)铵标准溶液(待标定)邻二氮菲-亚铁指示剂 (pH)试纸:1~14,6.2~8.4③有关物质的某些性质顺丁烯二酸酐:微溶于水、乙醇,遇热水发生反应.顺丁烯二酸:溶解度({78.8)(g)((25)(^circCelsius))},({392.6)(g)( (97.5)(^circCelsius) )}.反丁烯二酸:无色单斜棱晶,M_({r)}=(116.07),溶解度({0.7)(g)((25)(^circCelsius) )},({9.8)(g)((97.5)(^circCelsius) )}.熔点({287)(^circCelsius)},({165)(^circCelsius)}时升华.K_({a1)}=9.5times 10^-4,K_({a2)}=4.2times 10^-5.(FeSO_{4)cdot 7H_(2)O}:M_({r)}=(278.01),溶解度({26.3)(g)((20)(^circCelsius) )},({32.8)(g)((30)(^circCelsius))},({40.1)(g)((40)(^circCelsius))}.(Ce(SO_{4))2}:M_({r)}=332.24.K_({sp)}:(Fe(OH)2 1times 10^-15);(Fe(OH)3 3.8times 10^-38);(FeCO3 2.5times 10^-11).(3)操作步骤①反丁烯二酸的制备取(2.5)(g)顺丁烯二酸酞(由教师供给),放入(100)(mL)烧杯中,加入(20)(mL)水,温热溶解完全,然后加入(0.1)(g)硫脲(由教师供给)作催化剂,将此溶液在搅拌下加热,煮沸约(4)(min ).当有较多固体析出时立即冷却,结晶,抽滤,洗涤,水浴干燥后称重,记录产量.经教师签字后,产品用作下步实验的原料.②富马酸亚铁的制备将自制的全部反丁烯二酸置于(100)(mL)烧杯中,加水(20)(mL),在热沸搅拌下,加入(Na_{2)CO_(3)}溶液(自配)(10)(mL),使溶液(pH)为6.5~6.7.将上述溶液转移至(100)(mL)三口瓶中,溶液总体积不要超过(40)(mL).安装好回流装置.用电热套加热,搅拌,至沸.然后缓慢加入(FeSO_{4)}溶液(30)(mL)(约需8至(10)(min ).(FeSO_{4)}溶液配制方法:按反丁烯二酸与(FeSO_{4)cdot 7H_(2)O}质量比为1:2.6,称取(FeSO_{4)cdot 7H_(2)O},溶于(30)(mL)新煮沸过的冷水中),维持反应温度({100)(^circCelsius)},充分搅拌(1.5)(h).冷却,抽滤(垫双层滤纸),用水洗涤沉淀(5至6次)至基本无(SO^2-^[注]),水浴上干燥,得棕红(或棕)色粉末.记录产量,经教师签字后,产品用于分析.[注]:(SO^2-4)检验方法如下:将布氏漏斗从抽滤瓶上取出,加入少量水于沉淀上,改用试管收集滤液(1)(mL),加({6)(mol/L) HCl}溶液2滴,({0.1)(mol/L) BaCl_(2)}溶液1滴,无浑浊现象为合格.(此项检查的全过程必须监考老师在场,经老师确认签字方有效)③产品纯度测定a.硫酸铈(Ⅳ)铵标准溶液的标定 用公用的(25.00)(mL) 移液管分别取3份已酸化的硫酸亚铁铵标准溶液(浓度见当天的公布值)于(250)(mL)锥形瓶中,加新煮沸过的冷水(40)(mL),再加4滴邻二氮菲一亚铁指示剂,溶液呈红色.立即用硫酸铈(Ⅳ)铵标准溶液滴定.临近终点时滴定速度要放慢,直至溶液刚好变为浅蓝色即为终点.平行测定3份,记录滴定体积,计算每次标定的硫酸铈(Ⅳ)铵溶液的浓度并选取合适的数据计算其平均值.(注:已知空白实验消耗硫酸铈(Ⅳ)铵标准溶液体积为(0.02)(mL))b.产品纯度的测定 用减量法准确称取富血铁(0.30)(g)~(0.32)(g)(精确至(0.0001)(g)).加新煮沸过的({3)(mol/L) H_(2)SO_(4)}溶液(15)(mL),边温热边摇动.待样品溶解完全后,立即用流水冷却(可能会出现晶体).加新煮沸过的冷水(50)(mL)与6滴邻二氮菲一亚铁指示剂,随后操作步骤同标定.平行测定2份,计算每次样品中富血铁的百分含量和平均百分含量.(注:已知空白实验消耗硫酸铈(Ⅳ)铵标准溶液体积为(0.02)(mL))(4)思考题①写出制备反应中的有关化学反应方程式.②制备富马酸亚铁时,先要调节溶液(pH)为6.5~6.7.若反丁烯二酸取用量为(2.0)(g),应加入(Na_{2)CO_(3)}约为多少克?溶液酸度偏高、偏低各有何影响?请说明理由.
富血铁的制备及含量测定
(1)实验内容
富马酸亚铁,商品名富血铁,含铁量高$(33\%)$,较难被氧化为三价铁,在胃内铁不直接游离,血清铁值很快上升,对胃粘膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂.
①中间产品反丁烯二酸的制备:顺丁烯二酸肝溶于水,以硫脲为催化剂,加热制得反丁烯二酸(又称富马酸).
②产品富马酸亚铁的制备:以反丁烯二酸为原料,在适当的${pH}$条件下与${FeSO_{4}}$反应得富马酸亚铁.
③硫酸铈(Ⅳ)铵标准溶液的标定.
④产品的分析:用硫酸铈(Ⅳ)法测定.
⑤完成实验报告.
(2)主要仪器、试剂及材料
①主要仪器
数显搅拌恒温电热套:$1$台; 可调电炉:$1$个
布氏漏斗和抽滤瓶$1$套; 三口瓶${100}{mL}$:$1$个
球形冷凝管:$1$支; 铁架台:$2$个
量筒${100}{mL}$:$1$个,${10}{mL}\ 1$个; 烧杯${400}{mL} $:$3$个,${250}{mL}$:$1$个,${100}{mL}\ 2$个;${50}{mL}$:$1$个
酸式滴定管${50}{mL}$:$1$支; 称量瓶:$1$个
锥形瓶${250}{mL}\ 3$个; 滴定管夹:$1$只
塑料洗瓶:$1$个; 洗耳球:$1$个
玻棒:$2$支 搪瓷盘:$1$个
角匙:$1$把 刮匙:$1$个
表面皿:$3$只 培养皿:$1$只
公用仪器:
电子天平(最大称量$200$,$\pm {0.0001}{g}$),电子天平(最大称量$300$,$\pm {0.01}{g}$),移液管$({25}{mL})$
②试剂及材料
顺丁烯二酸酞:分析纯$(\text{AR})$ 硫酸亚铁:分析纯$(\text{AR})$
${{6}{mol/L}\ HCl}$溶液 硫脲:分析纯$(\text{AR})$
碳酸钠:分析纯$(\text{AR})$ 称量纸、滤纸
硫酸亚铁铵标准溶液 ${3}{mol/L}$;${H_{2}SO_{4}}$溶液
(浓度见公布值)
${{0.1}{mol/L}\ BaCl_{2}}$溶液 硫酸铈(Ⅳ)铵标准溶液(待标定)
邻二氮菲-亚铁指示剂 ${pH}$试纸:$1$~$14$,$6.2$~$8.4$
③有关物质的某些性质
顺丁烯二酸酐:微溶于水、乙醇,遇热水发生反应.
顺丁烯二酸:溶解度${{78.8}{g}({25}{^{\circ}Celsius})}$,${{392.6}{g}( {97.5}{^{\circ}Celsius} )}$.
反丁烯二酸:无色单斜棱晶,$M_{\text{r}}={116.07}$,
溶解度${{0.7}{g}({25}{^{\circ}Celsius} )}$,${{9.8}{g}({97.5}{^{\circ}Celsius} )}$.
熔点${{287}{^{\circ}Celsius}}$,${{165}{^{\circ}Celsius}}$时升华.
$K_{\text{a1}}=9.5\times 10^{-4}$,$K_{\text{a2}}=4.2\times 10^{-5}$.
${FeSO_{4}\cdot 7H_{2}O}$:$M_{\text{r}}={278.01}$,溶解度${{26.3}{g}({20}{^{\circ}Celsius} )}$,${{32.8}{g}({30}{^{\circ}Celsius})}$,${{40.1}{g}({40}{^{\circ}Celsius})}$.
${Ce\left(SO_{4}\right)2}$:$M_{\text{r}}=332.24$.
$K_{\text{sp}}$:${Fe(OH)2\ 1\times 10^{-15}}$;${Fe(OH)3\ 3.8\times 10^{-38}}$;${FeCO3\ 2.5\times 10^{-11}}$.
(3)操作步骤
①反丁烯二酸的制备
取${2.5}{g}$顺丁烯二酸酞(由教师供给),放入${100}{mL}$烧杯中,加入${20}{mL}$水,温热溶解完全,然后加入${0.1}{g}$硫脲(由教师供给)作催化剂,将此溶液在搅拌下加热,煮沸约${4}{\min }$.当有较多固体析出时立即冷却,结晶,抽滤,洗涤,水浴干燥后称重,记录产量.经教师签字后,产品用作下步实验的原料.
②富马酸亚铁的制备
将自制的全部反丁烯二酸置于${100}{mL}$烧杯中,加水${20}{mL}$,在热沸搅拌下,加入${Na_{2}CO_{3}}$溶液(自配)${10}{mL}$,使溶液${pH}$为$6.5$~$6.7$.将上述溶液转移至${100}{mL}$三口瓶中,溶液总体积不要超过${40}{mL}$.安装好回流装置.用电热套加热,搅拌,至沸.然后缓慢加入${FeSO_{4}}$溶液${30}{mL}$(约需$8$至${10}{\min }$.${FeSO_{4}}$溶液配制方法:按反丁烯二酸与${FeSO_{4}\cdot 7H_{2}O}$质量比为$1:2.6$,称取${FeSO_{4}\cdot 7H_{2}O}$,溶于${30}{mL}$新煮沸过的冷水中),维持反应温度${{100}{^{\circ}Celsius}}$,充分搅拌${1.5}{h}$.冷却,抽滤(垫双层滤纸),用水洗涤沉淀($5$至$6$次)至基本无${SO^{2-}^{[注]}}$,水浴上干燥,得棕红(或棕)色粉末.记录产量,经教师签字后,产品用于分析.
[注]:${SO^{2-}4}$检验方法如下:将布氏漏斗从抽滤瓶上取出,加入少量水于沉淀上,改用试管收集滤液${1}{mL}$,加${{6}{mol/L}\ HCl}$溶液$2$滴,${{0.1}{mol/L}\ BaCl_{2}}$溶液$1$滴,无浑浊现象为合格.
(此项检查的全过程必须监考老师在场,经老师确认签字方有效)
③产品纯度测定
a.硫酸铈(Ⅳ)铵标准溶液的标定 用公用的${25.00}{mL} $移液管分别取$3$份已酸化的硫酸亚铁铵标准溶液(浓度见当天的公布值)于${250}{mL}$锥形瓶中,加新煮沸过的冷水${40}{mL}$,再加$4$滴邻二氮菲一亚铁指示剂,溶液呈红色.立即用硫酸铈(Ⅳ)铵标准溶液滴定.临近终点时滴定速度要放慢,直至溶液刚好变为浅蓝色即为终点.平行测定$3$份,记录滴定体积,计算每次标定的硫酸铈(Ⅳ)铵溶液的浓度并选取合适的数据计算其平均值.(注:已知空白实验消耗硫酸铈(Ⅳ)铵标准溶液体积为${0.02}{mL}$)
b.产品纯度的测定 用减量法准确称取富血铁${0.30}{g}$~${0.32}{g}$(精确至${0.0001}{g}$).加新煮沸过的${{3}{mol/L}\ H_{2}SO_{4}}$溶液${15}{mL}$,边温热边摇动.待样品溶解完全后,立即用流水冷却(可能会出现晶体).加新煮沸过的冷水${50}{mL}$与$6$滴邻二氮菲一亚铁指示剂,随后操作步骤同标定.平行测定$2$份,计算每次样品中富血铁的百分含量和平均百分含量.(注:已知空白实验消耗硫酸铈(Ⅳ)铵标准溶液体积为${0.02}{mL}$)
(4)思考题
①写出制备反应中的有关化学反应方程式.
②制备富马酸亚铁时,先要调节溶液${pH}$为$6.5$~$6.7$.若反丁烯二酸取用量为${2.0}{g}$,应加入${Na_{2}CO_{3}}$约为多少克?溶液酸度偏高、偏低各有何影响?请说明理由.
题目解答
答案
(1)
①
②
③
④
⑤
(2)
①
②
③
(3)
①
②
③
a.
b.
(4)
①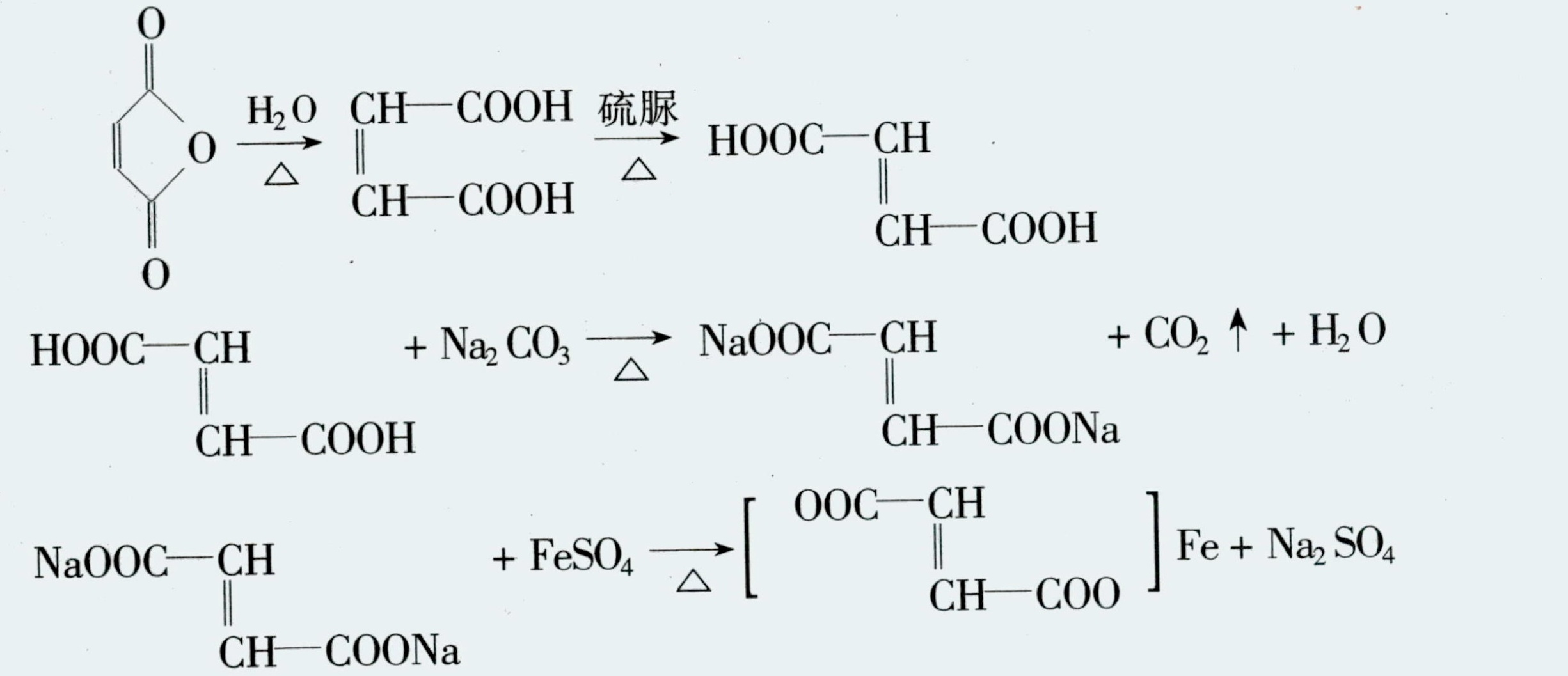
②根据上述第$3$步反应,酸与碳酸钠完全反应的质量比为$116/106$,为使所配的碳酸钠溶液留有一定余量,不至于补配,又不过量太多,取约$2$克${Na_{2}CO3}$为宜.由于富马酸是弱酸,酸度偏高会使${OOC-CH=CH-COO-}$所占的比例减小,不利于富马酸亚铁的形成;若酸度偏低,${Fe}$(Ⅱ)易被氧化形成${Fe}$(Ⅲ)(如${Fe(OH)3}$等),从而降低产率.