题目
(2分)已知AgCl的_(sp)^theta =1.77times (10)^-10,则AgCl在0.1mol·L-1的NaCl溶液中的溶解度s= 。
(2分)已知AgCl的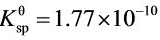 ,则AgCl在0.1mol·L-1的NaCl溶液中的溶解度s= 。
,则AgCl在0.1mol·L-1的NaCl溶液中的溶解度s= 。
题目解答
答案
1.77×10-9mol·L-1
解析
步骤 1:确定溶解度积常数
已知AgCl的溶解度积常数${K}_{sp}^{\theta }=1.77\times {10}^{-10}$。
步骤 2:写出AgCl的溶解平衡方程式
AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)
步骤 3:确定溶液中Cl⁻离子的浓度
由于NaCl完全电离,溶液中Cl⁻离子的浓度为0.1mol·L⁻¹。
步骤 4:计算Ag⁺离子的浓度
根据溶解度积常数${K}_{sp}^{\theta }=[Ag⁺][Cl⁻]$,代入已知的${K}_{sp}^{\theta }$和[Cl⁻],可以求出[Ag⁺]。
$1.77\times {10}^{-10} = [Ag⁺] \times 0.1$
$[Ag⁺] = \frac{1.77\times {10}^{-10}}{0.1} = 1.77\times {10}^{-9}$mol·L⁻¹
步骤 5:确定溶解度s
由于溶解度s等于[Ag⁺],所以s = 1.77×10⁻⁹mol·L⁻¹。
已知AgCl的溶解度积常数${K}_{sp}^{\theta }=1.77\times {10}^{-10}$。
步骤 2:写出AgCl的溶解平衡方程式
AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)
步骤 3:确定溶液中Cl⁻离子的浓度
由于NaCl完全电离,溶液中Cl⁻离子的浓度为0.1mol·L⁻¹。
步骤 4:计算Ag⁺离子的浓度
根据溶解度积常数${K}_{sp}^{\theta }=[Ag⁺][Cl⁻]$,代入已知的${K}_{sp}^{\theta }$和[Cl⁻],可以求出[Ag⁺]。
$1.77\times {10}^{-10} = [Ag⁺] \times 0.1$
$[Ag⁺] = \frac{1.77\times {10}^{-10}}{0.1} = 1.77\times {10}^{-9}$mol·L⁻¹
步骤 5:确定溶解度s
由于溶解度s等于[Ag⁺],所以s = 1.77×10⁻⁹mol·L⁻¹。