题目
在450 mL水中加入6。2 g NH4Cl (忽略其体积变化)和50 mL 1。0 mol∙L-1 NaOH 溶液,此混合溶液的pH是多少? (已知= 53.5,NH3的 pKb = 4.74)
在450 mL水中加入6。2 g NH4Cl (忽略其体积变化)和50 mL 1。0 mol∙L-1 NaOH 溶液,此混合溶液的pH是多少? (已知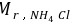 = 53.5,NH3的 pKb = 4.74)
= 53.5,NH3的 pKb = 4.74)
题目解答
答案
解:总体积V = 500 mL
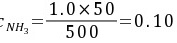 (mol∙L-1)
(mol∙L-1)
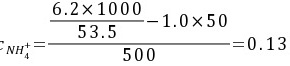 (mol∙L-1)
(mol∙L-1)
根据缓冲溶液[H+ ]的计算公式,有
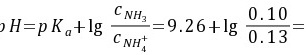 9。15
9。15
解析
步骤 1:计算NH4Cl的摩尔浓度
首先,计算6.2 g NH4Cl的摩尔数。NH4Cl的摩尔质量为53.5 g/mol。
\[ n_{NH4Cl} = \frac{6.2}{53.5} = 0.116 \text{ mol} \]
步骤 2:计算NaOH的摩尔浓度
NaOH的体积为50 mL,浓度为1.0 mol/L。
\[ n_{NaOH} = 1.0 \times \frac{50}{1000} = 0.05 \text{ mol} \]
步骤 3:计算NH4+和NH3的浓度
NH4Cl和NaOH反应生成NH3和NaCl。反应方程式为:
\[ NH4Cl + NaOH \rightarrow NH3 + NaCl + H2O \]
由于NaOH的摩尔数为0.05 mol,所以NH4Cl中0.05 mol的NH4+会转化为NH3。
\[ n_{NH3} = 0.05 \text{ mol} \]
剩余的NH4+摩尔数为:
\[ n_{NH4+} = 0.116 - 0.05 = 0.066 \text{ mol} \]
总体积为500 mL,所以NH4+和NH3的浓度分别为:
\[ [NH4+] = \frac{0.066}{0.5} = 0.132 \text{ mol/L} \]
\[ [NH3] = \frac{0.05}{0.5} = 0.10 \text{ mol/L} \]
步骤 4:计算pH值
根据缓冲溶液的pH计算公式:
\[ pH = pK_a + \log \frac{[NH3]}{[NH4+]} \]
NH3的pKb为4.74,所以pKa为:
\[ pK_a = 14 - pK_b = 14 - 4.74 = 9.26 \]
代入公式计算pH:
\[ pH = 9.26 + \log \frac{0.10}{0.132} = 9.26 - 0.11 = 9.15 \]
首先,计算6.2 g NH4Cl的摩尔数。NH4Cl的摩尔质量为53.5 g/mol。
\[ n_{NH4Cl} = \frac{6.2}{53.5} = 0.116 \text{ mol} \]
步骤 2:计算NaOH的摩尔浓度
NaOH的体积为50 mL,浓度为1.0 mol/L。
\[ n_{NaOH} = 1.0 \times \frac{50}{1000} = 0.05 \text{ mol} \]
步骤 3:计算NH4+和NH3的浓度
NH4Cl和NaOH反应生成NH3和NaCl。反应方程式为:
\[ NH4Cl + NaOH \rightarrow NH3 + NaCl + H2O \]
由于NaOH的摩尔数为0.05 mol,所以NH4Cl中0.05 mol的NH4+会转化为NH3。
\[ n_{NH3} = 0.05 \text{ mol} \]
剩余的NH4+摩尔数为:
\[ n_{NH4+} = 0.116 - 0.05 = 0.066 \text{ mol} \]
总体积为500 mL,所以NH4+和NH3的浓度分别为:
\[ [NH4+] = \frac{0.066}{0.5} = 0.132 \text{ mol/L} \]
\[ [NH3] = \frac{0.05}{0.5} = 0.10 \text{ mol/L} \]
步骤 4:计算pH值
根据缓冲溶液的pH计算公式:
\[ pH = pK_a + \log \frac{[NH3]}{[NH4+]} \]
NH3的pKb为4.74,所以pKa为:
\[ pK_a = 14 - pK_b = 14 - 4.74 = 9.26 \]
代入公式计算pH:
\[ pH = 9.26 + \log \frac{0.10}{0.132} = 9.26 - 0.11 = 9.15 \]