题目
":0 __-|||-l3= __-|||-__-|||-KOH美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.(1)a是 ____ 负极,电极反应式是 ____ 2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);b是 ____ 正极.电极反应式是 ____ O2+4e-+2H2O=4OH-.(2)飞船上宇航员的生活用水由燃料电池提供.若为飞行员提供了360kg的水,则电路中通过了 ____ 4×104mol的电子.
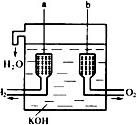 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电. 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.(1)a是 ____ 负 极,电极反应式是 ____ 2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O) ;b是 ____ 正 极.电极反应式是 ____ O2+4e-+2H2O=4OH- .(2)飞船上宇航员的生活用水由燃料电池提供.若为飞行员提供了360kg的水,则电路中通过了 ____ 4×104 mol的电子. |
题目解答
答案
| 分析:(1)氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O; (2)在2H2+O2=2H2O中,化合价升高值=化合价降低值=4,即当转移电子4mol时,会有2mol的水生成. |
| (1)氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),正极电极反应式为O2+4e-+2H2O=4OH-,故答案为:负;2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);正;O2+4e-+2H2O=4OH-; (2)氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,即2H2+O2=2H2O,在2H2+O2=2H2O中,化合价升高值=化合价降低值=4,即当转移电子4mol时,会有2mol即36g的水生成,当为飞行员提供了360kg即2×104mol的水时,会转移电子4×104mol,故答案为:4×104. |
| 点评:本题考查原电池中的氢氧燃料电池的工作原理,题目难度不大,注意电极方程式的书写以及电解质溶液的酸碱性. |
解析
步骤 1:确定电极类型
在氢氧燃料电池中,氢气(H_2)在负极(a)发生氧化反应,氧气(O_2)在正极(b)发生还原反应。因此,a是负极,b是正极。
步骤 2:写出电极反应式
在碱性电解质中,负极(a)的电极反应式为:2H_2-4e^{-}+4OH^{-}=4H_2O(或H_2-2e^{-}+2OH^{-}=2H_2O)。
正极(b)的电极反应式为:O_2+4e^{-}+2H_2O=4OH^{-}。
步骤 3:计算电子转移量
根据氢氧燃料电池的总反应2H_2+O_2=2H_2O,每生成2mol水,转移4mol电子。因此,若生成360kg(即2×10^{4}mol)水,转移的电子量为4×10^{4}mol。
在氢氧燃料电池中,氢气(H_2)在负极(a)发生氧化反应,氧气(O_2)在正极(b)发生还原反应。因此,a是负极,b是正极。
步骤 2:写出电极反应式
在碱性电解质中,负极(a)的电极反应式为:2H_2-4e^{-}+4OH^{-}=4H_2O(或H_2-2e^{-}+2OH^{-}=2H_2O)。
正极(b)的电极反应式为:O_2+4e^{-}+2H_2O=4OH^{-}。
步骤 3:计算电子转移量
根据氢氧燃料电池的总反应2H_2+O_2=2H_2O,每生成2mol水,转移4mol电子。因此,若生成360kg(即2×10^{4}mol)水,转移的电子量为4×10^{4}mol。