某溶液中含有NaOH及CH3COOC2H5,浓度均为0.01mol.dm-3。在298K时,反应经10min有39%的CH3COOC2H5分解,而在308K时,反应10min有55%的CH3COOC2H5分解。该反应速率方程为r=k[NaOH][ CH3COOC2H5]。试计算:(1) 在298K和308K时反应的速率常数;(2) 在288K时,反应10min,CH3COOC2H5的分解分数;(3) 293K时,若有50%的CH3COOC2H5分解,所需的时间。
某溶液中含有NaOH及CH3COOC2H5,浓度均为0.01mol.dm-3。在298K时,反应经10min有39%的CH3COOC2H5分解,而在308K时,反应10min有55%的CH3COOC2H5分解。该反应速率方程为r=k[NaOH][ CH3COOC2H5]。试计算:
(1) 在298K和308K时反应的速率常数;
(2) 在288K时,反应10min,CH3COOC2H5的分解分数;
(3) 293K时,若有50%的CH3COOC2H5分解,所需的时间。
题目解答
答案
解:
(1) 1/(a –x) –1/a=kt
1/(0.01 –0.39×0.01) –1/0.01=10k(298K)
k(298K)={1/(0.01 –0.39×0.01) –1/0.01}/10=6.3934 mol-1.dm3.s-1
1/(0.01 –0.55×0.01) –1/0.01=10k(308K)
k(308K)={1/(0.01 –0.55×0.01) –1/0.01}/10=12.2222mol-1.dm3.s-1
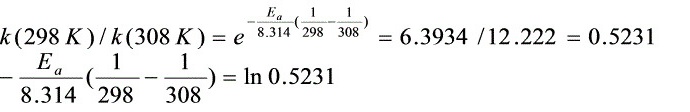 (2)
(2)
E= –8.314×298×308/(308–298)ln0.5231=49.447kJmol
k(288K)= k(298K)/1.9997=6.3934/1.9997=3.1972 moldms
1/(0.01–x) –1/0.01=3.1972×10
1/(0.01–x) =131.972
0.01–x =0.007577
x =0.002423
x/a=0.002423/0.01=24.23%
(3)
k(293K)= k(298K)/1.40576=6.3934/1.40576=4.548 moldms
1/(0.01–0.50×0.01) –1/0.01=4.548t
t={1/(0.01–0.50×0.01) –1/0.01}/4.548=21.99min
解析
根据题目给出的反应速率方程r=k[NaOH][CH3COOC2H5],以及反应10min有39%的CH3COOC2H5分解,可以得到反应的速率常数k(298K)。利用公式1/(a –x) –1/a=kt,其中a为初始浓度,x为分解的浓度,t为时间,k为速率常数。
步骤 2:计算308K时的速率常数
同理,根据反应10min有55%的CH3COOC2H5分解,可以得到反应的速率常数k(308K)。
步骤 3:计算288K时的分解分数
利用阿伦尼乌斯方程,计算288K时的速率常数k(288K),然后利用速率常数和反应时间计算出CH3COOC2H5的分解分数。
步骤 4:计算293K时的分解时间
利用阿伦尼乌斯方程,计算293K时的速率常数k(293K),然后利用速率常数和分解分数计算出所需的时间。