+PH-|||- c-|||-b.-|||-ō 2(N OH 50溶液)/mL室温下,用0.1mol•L-1的NaOH溶液滴定25mL0.1mol•L-1H2C2O4(草酸)溶液的滴定曲线如图所示[已知:Ka1(H2C2O4)=5×10-2,Ka2(H2C2O4)=2×10-4,忽略溶液混合时体积和温度的变化,lg2=0.3,lg3=0.5,电离度=((已电离的溶质分子数))/((原有溶质分子总数))×100%]。下列说法正确的是( ) A. a点溶液中,0.1mol•L-1的H2C2O4溶液的电离度为50% B. b点溶液中各离子浓度大小关系为c(Na+)>c(HC2O4-)>c(OH-)>c(H+)>c(C2O42-) C. c点溶液中一定存在c(OH-)-c(H+)<c(HC2O4-)+c(H2C2O4) D. d的值为8.9
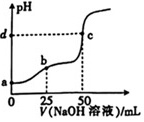 室温下,用0.1mol•L-1的NaOH溶液滴定25mL0.1mol•L-1H2C2O4(草酸)溶液的滴定曲线如图所示[已知:Ka1(H2C2O4)=5×10-2,Ka2(H2C2O4)=2×10-4,忽略溶液混合时体积和温度的变化,lg2=0.3,lg3=0.5,电离度=$\frac{{已电离的溶质分子数}}{{原有溶质分子总数}}$×100%]。下列说法正确的是( )
室温下,用0.1mol•L-1的NaOH溶液滴定25mL0.1mol•L-1H2C2O4(草酸)溶液的滴定曲线如图所示[已知:Ka1(H2C2O4)=5×10-2,Ka2(H2C2O4)=2×10-4,忽略溶液混合时体积和温度的变化,lg2=0.3,lg3=0.5,电离度=$\frac{{已电离的溶质分子数}}{{原有溶质分子总数}}$×100%]。下列说法正确的是( )- A. a点溶液中,0.1mol•L-1的H2C2O4溶液的电离度为50%
- B. b点溶液中各离子浓度大小关系为c(Na+)>c(HC2O4-)>c(OH-)>c(H+)>c(C2O42-)
- C. c点溶液中一定存在c(OH-)-c(H+)<c(HC2O4-)+c(H2C2O4)
- D. d的值为8.9
题目解答
答案
B.b点溶液中溶质为NaHC2O4,HC2O4-的电离程度大于水解程度,溶液呈酸性,各离子浓度大小关系为c(Na+)>c(HC2O )>c(H+)>c(C2O42-)>c(OH-),故B错误;
C.c点溶液中的溶质是Na2C2O4,根据质子守恒,c(OH-)-c(H+)=c(HC2O4-)+2c(H2C2O4),所以c(OH-)-c(H+)>c(HC2O4-)+c(H2C2O4),故C错误;
D.c点溶液中的溶质是Na2C2O4,Na2C2O4的浓度是$\frac{25mL×0.1mol/L}{75mL}$=$\frac{1}{30}$mol/L,$\frac{{c}^{2}(O{H}^{-})}{\frac{1}{30}}$=$\frac{1{0}^{-14}}{2×1{0}^{-4}}$,c(OH-)=$\sqrt{\frac{5}{3}}$×10-6mol/L,c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{\sqrt{\frac{5}{3}}×1{0}^{-6}}$mol/L=$\sqrt{\frac{3}{5}}×1{0}^{-8}$mol/L,pH的值为8.1,故D错误;
故选:A。
解析
本题考查强碱滴定弱酸的滴定曲线,涉及电离度计算、盐类水解、质子守恒及pH计算。解题核心在于:
- 识别各滴定点对应的溶质:a点为纯草酸,b点为NaHC₂O₄,c点为Na₂C₂O₄;
- 判断溶液酸碱性:根据酸式盐的电离与水解程度分析离子浓度;
- 守恒关系应用:质子守恒与电荷守恒的灵活运用;
- 分步计算:利用水解平衡计算pH时需注意浓度稀释。
选项A分析
电离度计算:
设草酸电离度为$\alpha$,则电离浓度$x=0.1\alpha$。根据$K_{a1}=\frac{x^2}{0.1-x}=5\times10^{-2}$,解得$x=0.05$,故$\alpha=50\%$。选项A正确。
选项B分析
离子浓度顺序:
b点溶质为NaHC₂O₄,HC₂O₄⁻电离程度大于水解(因$K_{a2}=2\times10^{-4}$接近水解常数),溶液呈酸性。正确顺序应为$c(\text{Na}^+) > c(\text{HC}_2\text{O}_4^-) > c(\text{H}^+) > c(\text{C}_2\text{O}_4^{2-}) > c(\text{OH}^-)$。选项B错误。
选项C分析
质子守恒应用:
c点溶质为Na₂C₂O₄,质子守恒式为:
$c(\text{OH}^-)-c(\text{H}^+)=c(\text{HC}_2\text{O}_4^-)+2c(\text{H}_2\text{C}_2\text{O}_4)$
选项中未包含系数2,故$c(\text{OH}^-)-c(\text{H}^+) > c(\text{HC}_2\text{O}_4^-)+c(\text{H}_2\text{C}_2\text{O}_4)$。选项C错误。
选项D分析
pH计算:
c点溶质浓度为$\frac{25 \times 0.1}{75} = \frac{1}{30}$ mol/L。水解平衡中:
$\frac{c^2(\text{OH}^-)}{\frac{1}{30}} = \frac{K_w}{K_{a2}} = \frac{10^{-14}}{2\times10^{-4}}$
解得$c(\text{OH}^-)=\sqrt{\frac{5}{3}} \times 10^{-6}$,进一步计算得$pH \approx 8.1$,而非8.9。选项D错误。