题目
(20)下列三种分子(或分子离子)的键角顺序是-|||-(A) (N{O)_(2)}^+gt N(O)_(2)gt (N{O)_(2)}^- (B) (N{O)_(2)}^+lt N(O)_(2)lt (N{O)_(2)}^--|||-(C)三种分子的键角相等

题目解答
答案
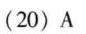
解析
本题考查分子几何结构与键角的关系,核心在于理解孤对电子对键角的影响。根据VSEPR理论,孤对电子数目越多,键角越小。三种分子离子的中心原子氮的孤对电子数目不同,导致键角大小不同。NO₂⁺无孤对,键角最大;NO₂有一个孤对,键角次之;NO₂⁻有两个孤对,键角最小。
分析三种分子离子的孤对电子数目:
-
${NO_2}^+$
- 氮原子通过双键与两个氧原子成键,无孤对电子。
- 价层电子对数为3(均为成键对),呈平面三角形结构,键角为$120^\circ$。
-
$NO_2$
- 氮原子通过双键与两个氧原子成键,有一个孤对电子。
- 价层电子对数为3(2对成键,1对孤对),呈V形结构,键角约为$134^\circ$(小于$120^\circ$)。
-
${NO_2}^-$
- 氮原子通过双键与两个氧原子成键,有两个孤对电子。
- 价层电子对数为3(2对成键,2对孤对),呈V形结构,键角进一步减小,约为$115^\circ$。
结论:
键角顺序为:${NO_2}^+ > NO_2 > {NO_2}^-$,对应选项A。