题目
3.水在20℃时的饱和蒸气压力为2.34kP a。若于100g水中溶有10.0g蔗糖( _(1)=342, 求此溶液-|||-的蒸气压力。
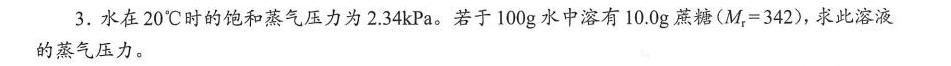
题目解答
答案
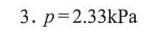
解析
考查要点:本题主要考查溶液蒸气压的计算,涉及拉乌尔定律的应用,以及摩尔分数的计算。
解题核心思路:
根据拉乌尔定律,溶液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数。因此,需要先计算溶剂(水)和溶质(蔗糖)的物质的量,再求出水的摩尔分数,最后代入公式求解。
破题关键点:
- 正确区分溶剂与溶质:水是溶剂,蔗糖是溶质。
- 准确计算物质的量:水的摩尔数和蔗糖的摩尔数需分别计算。
- 摩尔分数的计算:溶剂的摩尔分数是溶剂的物质的量占总物质的量的比例。
步骤1:计算水的物质的量
水的摩尔质量为 $18 \, \text{g/mol}$,质量为 $100 \, \text{g}$,则:
$n_{\text{水}} = \frac{100}{18} \approx 5.5556 \, \text{mol}$
步骤2:计算蔗糖的物质的量
蔗糖的摩尔质量为 $342 \, \text{g/mol}$,质量为 $10.0 \, \text{g}$,则:
$n_{\text{蔗糖}} = \frac{10.0}{342} \approx 0.02924 \, \text{mol}$
步骤3:计算总物质的量
总物质的量为水和蔗糖的物质的量之和:
$n_{\text{总}} = 5.5556 + 0.02924 \approx 5.5848 \, \text{mol}$
步骤4:计算水的摩尔分数
水的摩尔分数为:
$X_{\text{水}} = \frac{n_{\text{水}}}{n_{\text{总}}} = \frac{5.5556}{5.5848} \approx 0.9948$
步骤5:应用拉乌尔定律计算蒸气压
根据公式 $P = P_0 \cdot X_{\text{水}}$,代入已知数据:
$P = 2.34 \, \text{kPa} \times 0.9948 \approx 2.33 \, \text{kPa}$