题目
苯甲醇与苯甲酸都是常见化工原料,在化工生产中有广泛应用。工业上常在碱性条件下由苯甲醛来制备。某实验室模拟其生产过程,实验原理、实验方法及步骤如下:实验原理:2+KOH→+有关资料: 名称 相对分子质量 熔点(℃) 沸点(℃) 溶解性 水 醇 醚 苯甲醛 106 -26 179.62 微溶 易溶 易溶 苯甲酸 122 122.13 249 微溶 易溶 易溶 苯甲醇 108 -15.3 205.7 微溶 易溶 易溶 乙醚 74 -116.3 34.6 微溶 易溶 -- 苯甲醛空气中极易被氧化,生成白色苯甲酸。实验步骤及方法如下:Ⅰ.向盛有足量KOH溶液的反应器中,分批加入新蒸过的13.5mL(14.0g)苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上;反应装置如图1。Ⅱ.步骤Ⅰ所得产物后续处理如图2。(1)仪器a的名称为 ____ 。(2)步骤1中苯甲醛需要分批加入且适时冷却,其原因是 ____ 。(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后 ____ (填“上”或“下”)层液体加入无水MgSO4,其作用为 ____ ,操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为 ____ 。(4)水层中加入浓盐酸发生反应的离子方程式为 ____ 。(5)操作②包含溶解、蒸发浓缩、结晶、晾干,下列仪器中在该操作中不需要用到的有 ____ 。(填序号)A.分液漏斗B.蒸发皿C.研钵D.玻璃棒(6)①若产品2产率比预期值稍高,可能原因是 ____ 。A.过滤后未干燥完全B.产品中混有其他杂质C.过滤时滤液浑浊D.部分苯甲醛被直接氧化为苯甲酸②产品2经干燥后称量,质量为6.1g,计算其产率为 ____ 。(保留3位有效数字,写出计算过程)
苯甲醇与苯甲酸都是常见化工原料,在化工生产中有广泛应用。工业上常在碱性条件下由苯甲醛来制备。某实验室模拟其生产过程,实验原理、实验方法及步骤如下:
实验原理:2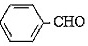 +KOH→
+KOH→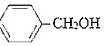 +
+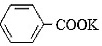
有关资料:
苯甲醛空气中极易被氧化,生成白色苯甲酸。
实验步骤及方法如下:
Ⅰ.向盛有足量KOH溶液的反应器中,分批加入新蒸过的13.5mL(14.0g)苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上;反应装置如图1。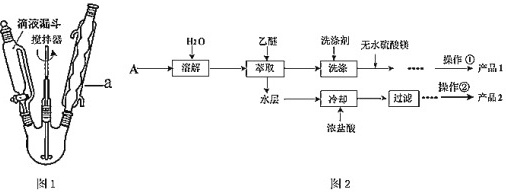
Ⅱ.步骤Ⅰ所得产物后续处理如图2。
(1)仪器a的名称为 ____ 。
(2)步骤1中苯甲醛需要分批加入且适时冷却,其原因是 ____ 。
(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后 ____ (填“上”或“下”)层液体加入无水MgSO4,其作用为 ____ ,操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为 ____ 。
(4)水层中加入浓盐酸发生反应的离子方程式为 ____ 。
(5)操作②包含溶解、蒸发浓缩、结晶、晾干,下列仪器中在该操作中不需要用到的有 ____ 。(填序号)
A.分液漏斗
B.蒸发皿
C.研钵
D.玻璃棒
(6)①若产品2产率比预期值稍高,可能原因是 ____ 。
A.过滤后未干燥完全
B.产品中混有其他杂质
C.过滤时滤液浑浊
D.部分苯甲醛被直接氧化为苯甲酸
②产品2经干燥后称量,质量为6.1g,计算其产率为 ____ 。(保留3位有效数字,写出计算过程)
实验原理:2
 +KOH→
+KOH→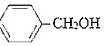 +
+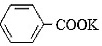
有关资料:
| 名称 | 相对分子质量 | 熔点 (℃) |
沸点 (℃) |
溶解性 | ||
| 水 | 醇 | 醚 | ||||
| 苯甲醛 | 106 | -26 | 179.62 | 微溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶 | 易溶 | 易溶 |
| 苯甲醇 | 108 | -15.3 | 205.7 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 74 | -116.3 | 34.6 | 微溶 | 易溶 | -- |
实验步骤及方法如下:
Ⅰ.向盛有足量KOH溶液的反应器中,分批加入新蒸过的13.5mL(14.0g)苯甲醛,持续搅拌至反应混合物变成白色蜡糊状A,转移至锥形瓶中静置24小时以上;反应装置如图1。

Ⅱ.步骤Ⅰ所得产物后续处理如图2。
(1)仪器a的名称为 ____ 。
(2)步骤1中苯甲醛需要分批加入且适时冷却,其原因是 ____ 。
(3)为获取产品1,将乙醚萃取液依次用饱和亚硫酸氢钠溶液、10%碳酸钠溶液和水进行洗涤并分液。乙醚萃取液的密度小于水,取分液后 ____ (填“上”或“下”)层液体加入无水MgSO4,其作用为 ____ ,操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为 ____ 。
(4)水层中加入浓盐酸发生反应的离子方程式为 ____ 。
(5)操作②包含溶解、蒸发浓缩、结晶、晾干,下列仪器中在该操作中不需要用到的有 ____ 。(填序号)
A.分液漏斗
B.蒸发皿
C.研钵
D.玻璃棒
(6)①若产品2产率比预期值稍高,可能原因是 ____ 。
A.过滤后未干燥完全
B.产品中混有其他杂质
C.过滤时滤液浑浊
D.部分苯甲醛被直接氧化为苯甲酸
②产品2经干燥后称量,质量为6.1g,计算其产率为 ____ 。(保留3位有效数字,写出计算过程)
题目解答
答案
解:(1)根据图示可知:仪器a的名称为球形冷凝管,
故答案为:球形冷凝管;
(2)在步骤1中苯甲醛需要分批加入且适时冷却,是因为该反应是放热反应,温度过高,反应过于剧烈,会导致苯甲醛、苯甲醇挥发,同时也会使副反应产物增多,使产品的产率降低,这样就可以减缓反应速率,提高产品的产率,
故答案为:分批次加入苯甲醛并适时冷却,能够使反应不太剧烈,降低反应温度,避免苯甲醛、苯甲醇的挥发,减少副反应的发生,提高产率;
(3)为获取产品1,将乙醚萃取液先用饱和亚硫酸氢钠溶液除去未反应的苯甲醛,再用10%碳酸钠溶液除去醚层中极少量的苯甲酸,最后用水进行洗涤并分液;由于乙醚萃取液的密度小于水,因此苯甲醇的乙醚溶液在上层,取分液后上层液体向其中加入无水MgSO4进行干燥,吸收其中少量水分。操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为蒸馏,
故答案为:上;干燥乙醚萃取液;蒸馏;
(4)水层中含苯甲酸钾溶液,向加入浓盐酸,发生复分解反应产生难溶性的苯甲酸和KCl,反应的离子方程式为:C6H5-COO-+H+→C6H5-COOH↓,
故答案为:C6H5-COO-+H+→C6H5-COOH↓;
(5)操作②包含溶解、蒸发浓缩、结晶、晾干,需要的仪器有烧杯、玻璃棒、酒精灯、蒸发皿,在如图所示仪器中,不需要的仪器有分液漏斗和研钵,故合理选项是AC,
故答案为:AC;
(6)①A.若过滤后未干燥完全,把水当作苯甲酸,则其产率偏高,故A正确;
B.若产品中混有其他杂质,也会使苯甲酸的质量偏大,最终导致产率偏高,故B正确;
C.若过滤时滤液浑浊,有部分苯甲酸滞留在滤液中,使得苯甲酸固体质量偏少,最终导致产率偏低,故C错误;
D.若部分苯甲醛被直接氧化为苯甲酸,则苯甲酸质量偏多,导致其产率偏高,故D正确;
故答案为:ABD;
②根据方程式可知:2C6H5-CHO→C6H5-COOH,即2×106g苯甲醛反应完全产生122g苯甲酸,现在参加反应的苯甲醛质量是14.0g,则理论上反应制取的苯甲酸质量为m(苯甲酸)=$\frac{122g}{2×106g}$×14g≈8.057g,实际产量是6.1g,则苯甲酸的产率为:$\frac{6.1g}{8.057g}$×100%≈75.7%,
故答案为:75.7%。
故答案为:球形冷凝管;
(2)在步骤1中苯甲醛需要分批加入且适时冷却,是因为该反应是放热反应,温度过高,反应过于剧烈,会导致苯甲醛、苯甲醇挥发,同时也会使副反应产物增多,使产品的产率降低,这样就可以减缓反应速率,提高产品的产率,
故答案为:分批次加入苯甲醛并适时冷却,能够使反应不太剧烈,降低反应温度,避免苯甲醛、苯甲醇的挥发,减少副反应的发生,提高产率;
(3)为获取产品1,将乙醚萃取液先用饱和亚硫酸氢钠溶液除去未反应的苯甲醛,再用10%碳酸钠溶液除去醚层中极少量的苯甲酸,最后用水进行洗涤并分液;由于乙醚萃取液的密度小于水,因此苯甲醇的乙醚溶液在上层,取分液后上层液体向其中加入无水MgSO4进行干燥,吸收其中少量水分。操作①含多步操作,其中最后一步分离操作是对乙醚和产品1进行分离,其名称为蒸馏,
故答案为:上;干燥乙醚萃取液;蒸馏;
(4)水层中含苯甲酸钾溶液,向加入浓盐酸,发生复分解反应产生难溶性的苯甲酸和KCl,反应的离子方程式为:C6H5-COO-+H+→C6H5-COOH↓,
故答案为:C6H5-COO-+H+→C6H5-COOH↓;
(5)操作②包含溶解、蒸发浓缩、结晶、晾干,需要的仪器有烧杯、玻璃棒、酒精灯、蒸发皿,在如图所示仪器中,不需要的仪器有分液漏斗和研钵,故合理选项是AC,
故答案为:AC;
(6)①A.若过滤后未干燥完全,把水当作苯甲酸,则其产率偏高,故A正确;
B.若产品中混有其他杂质,也会使苯甲酸的质量偏大,最终导致产率偏高,故B正确;
C.若过滤时滤液浑浊,有部分苯甲酸滞留在滤液中,使得苯甲酸固体质量偏少,最终导致产率偏低,故C错误;
D.若部分苯甲醛被直接氧化为苯甲酸,则苯甲酸质量偏多,导致其产率偏高,故D正确;
故答案为:ABD;
②根据方程式可知:2C6H5-CHO→C6H5-COOH,即2×106g苯甲醛反应完全产生122g苯甲酸,现在参加反应的苯甲醛质量是14.0g,则理论上反应制取的苯甲酸质量为m(苯甲酸)=$\frac{122g}{2×106g}$×14g≈8.057g,实际产量是6.1g,则苯甲酸的产率为:$\frac{6.1g}{8.057g}$×100%≈75.7%,
故答案为:75.7%。