题目
某焦炉煤气,成分同上题,燃烧时空气消耗系数n=0.8,产物温度为1200℃,设产物中O2,=0,并忽略CH4,不计,试计算不完全燃烧产物的成分及生成量。
某焦炉煤气,成分同上题,燃烧时空气消耗系数n=0.8,产物温度为1200℃,设产物中O2,=0,并忽略CH4,不计,试计算不完全燃烧产物的成分及生成量。
题目解答
答案
解:(1)碳平衡公式:
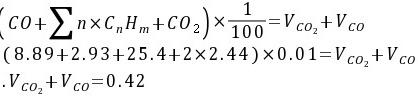
(2)氢平衡方程式:
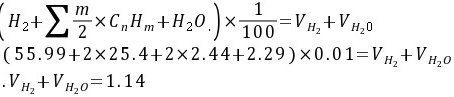
(3)氧平衡方程式:
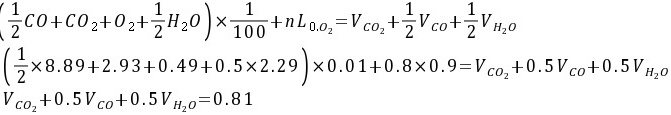
(4)氮平衡方程式:

(5)水煤气反应平衡常 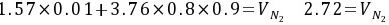
查附表6 当t=1200℃时,K=0.387
各式联立求解得: 算得百分比为:
V= 0.207(m/m) H= 4.84
VH2 = 0.153 (m3/m3) CO2= 3.57
VCO = 0.267(m3/m3) CO, = 6.24
VCO2 = 0.933(m3/m3) H2O,= 21.80
VH2O = 2.72(m3/m3) N2,= 63.55
VN2 = 4.28(m3/m3)
解析
步骤 1:碳平衡公式
根据碳平衡原理,焦炉煤气中碳元素的总量等于燃烧产物中CO和CO2的碳元素总量。焦炉煤气中碳元素的总量为各碳氢化合物中碳元素的总和,即:
$(0.39+2.93+25.4+2\times 2.44)\times \dfrac {1}{100}={V}_{C{O}_{2}}+{V}_{CO}$
步骤 2:氢平衡方程式
根据氢平衡原理,焦炉煤气中氢元素的总量等于燃烧产物中H2和H2O的氢元素总量。焦炉煤气中氢元素的总量为各碳氢化合物中氢元素的总和,即:
$(55.99+2\times 25.4+2\times 2.44+2.29)\times 0.01={V}_{{H}_{2}}+{V}_{{H}_{2}O}$
步骤 3:氧平衡方程式
根据氧平衡原理,焦炉煤气中氧元素的总量加上空气中的氧元素总量等于燃烧产物中CO2、CO和H2O的氧元素总量。焦炉煤气中氧元素的总量为各碳氢化合物中氧元素的总和,即:
$(\dfrac {1}{2}\times 0.39+0.93+0.49+0.5\times 2.25)\times 0.01+0.8\times 0.9={V}_{C{O}_{2}}+\dfrac {1}{2}VCO+\dfrac {1}{2}{V}_{{H}_{2}O}$
步骤 4:氮平衡方程式
根据氮平衡原理,焦炉煤气中氮元素的总量加上空气中的氮元素总量等于燃烧产物中N2的氮元素总量。焦炉煤气中氮元素的总量为各碳氢化合物中氮元素的总和,即:
$0.02+3.76nL={V}_{{N}_{2}}$
步骤 5:水煤气反应平衡常数
根据水煤气反应平衡常数,计算燃烧产物中CO和H2O的摩尔比,即:
$K=\dfrac {[CO][H_{2}O]}{[CO_{2}][H_{2}]}$
步骤 6:联立方程求解
将上述方程联立求解,得到燃烧产物中各组分的体积分数。
根据碳平衡原理,焦炉煤气中碳元素的总量等于燃烧产物中CO和CO2的碳元素总量。焦炉煤气中碳元素的总量为各碳氢化合物中碳元素的总和,即:
$(0.39+2.93+25.4+2\times 2.44)\times \dfrac {1}{100}={V}_{C{O}_{2}}+{V}_{CO}$
步骤 2:氢平衡方程式
根据氢平衡原理,焦炉煤气中氢元素的总量等于燃烧产物中H2和H2O的氢元素总量。焦炉煤气中氢元素的总量为各碳氢化合物中氢元素的总和,即:
$(55.99+2\times 25.4+2\times 2.44+2.29)\times 0.01={V}_{{H}_{2}}+{V}_{{H}_{2}O}$
步骤 3:氧平衡方程式
根据氧平衡原理,焦炉煤气中氧元素的总量加上空气中的氧元素总量等于燃烧产物中CO2、CO和H2O的氧元素总量。焦炉煤气中氧元素的总量为各碳氢化合物中氧元素的总和,即:
$(\dfrac {1}{2}\times 0.39+0.93+0.49+0.5\times 2.25)\times 0.01+0.8\times 0.9={V}_{C{O}_{2}}+\dfrac {1}{2}VCO+\dfrac {1}{2}{V}_{{H}_{2}O}$
步骤 4:氮平衡方程式
根据氮平衡原理,焦炉煤气中氮元素的总量加上空气中的氮元素总量等于燃烧产物中N2的氮元素总量。焦炉煤气中氮元素的总量为各碳氢化合物中氮元素的总和,即:
$0.02+3.76nL={V}_{{N}_{2}}$
步骤 5:水煤气反应平衡常数
根据水煤气反应平衡常数,计算燃烧产物中CO和H2O的摩尔比,即:
$K=\dfrac {[CO][H_{2}O]}{[CO_{2}][H_{2}]}$
步骤 6:联立方程求解
将上述方程联立求解,得到燃烧产物中各组分的体积分数。