题目
①-|||-②乙酸乙酯是一种用途广泛的精细化工产品,被广泛用于醋酸纤维、乙烯树脂、合成橡胶、涂料及油漆等的生产过程中。Ⅰ.乙酸乙酯的制备。(1)球形干燥管有冷凝的作用外,还能起到的作用为 ____ 。(2)按图连接好装置,依次在试管①中装入乙醇、浓硫酸、乙酸、碎瓷片,②中盛装的试剂是 ____ 。Ⅱ.乙酸乙酯的反应机理探究。用乙醇羟基氧示踪:CH3COOH+H18OCH2CH3(underline(;浓硫酸;))/(△) ____ + ____ 。用醋酸羟基氧示踪:①-|||-②+H3C-CH2-OH(underline(;浓硫酸;))/(△)①-|||-②+H218O。(3)模仿醋酸羟基氧示踪法,写出乙醇羟基氧示踪法的产物为 ____ 和 ____ 。(4)已知醋酸羟基氧示踪法中,产物含氧18水占到总水量的一半,酯也一样。该实验说明酯化反应 ____ (填“是”或“不是”)简单的取代反应。(5)在投料1:1的情况下,测得120℃时,CH3COOH平衡转化率为65%,该温度下反应的平衡常数K= ____ 。(保留三位有效数字)Ⅲ.乙酸乙酯的催化水解(酯化反应的逆反应)探究。已知:①乙酸乙酯的沸点约77℃;②酸和碱均可用作酯水解的催化剂。实验步骤:向试管中加入8molNaOH溶液,再加入2mL乙酸乙酯,量出乙酸乙酯的高度。再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行。改变NaOH溶液的浓度,重复实验。乙酸乙酯水解后剩余高度/mm数据如表所示: 组别 c(NaOH)/mol•L-1 时间/min 0 1 2 3 4 5 6 7 8 1 0.5 10.0 9.0 8.0 7.5 7.0 6.5 6.5 6.5 6.5 2 1.0 10.0 8.5 7.0 6.0 5.0 4.5 4.5 4.5 4.5 3 2.0 10.0 8.0 6.0 4.5 3.0 2.0 1.5 1.5 1.5 回答下列问题:(6)分析上述数据,得到乙酸乙酯水解速率的规律是:①NaOH溶液浓度越大,水解速率越 ____ ;② ____ 。(7)结论②的理论解释是 ____ 。(8)该实验必须严格控制NaOH溶液的体积、乙酸乙酯的用量和反应的温度。为了达到实验的目的,有同学建议用 ____ 代替NaOH溶液重复试验,对数据进行修正。
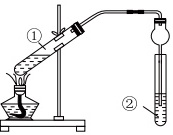 乙酸乙酯是一种用途广泛的精细化工产品,被广泛用于醋酸纤维、乙烯树脂、合成橡胶、涂料及油漆等的生产过程中。
乙酸乙酯是一种用途广泛的精细化工产品,被广泛用于醋酸纤维、乙烯树脂、合成橡胶、涂料及油漆等的生产过程中。Ⅰ.乙酸乙酯的制备。
(1)球形干燥管有冷凝的作用外,还能起到的作用为 ____ 。
(2)按图连接好装置,依次在试管①中装入乙醇、浓硫酸、乙酸、碎瓷片,②中盛装的试剂是 ____ 。
Ⅱ.乙酸乙酯的反应机理探究。
用乙醇羟基氧示踪:CH3COOH+H18OCH2CH3$\frac{\underline{\;浓硫酸\;}}{△}$ ____ + ____ 。
用醋酸羟基氧示踪:
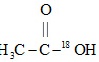 +H3C-CH2-OH$\frac{\underline{\;浓硫酸\;}}{△}$
+H3C-CH2-OH$\frac{\underline{\;浓硫酸\;}}{△}$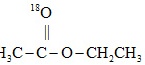 +H218O。
+H218O。(3)模仿醋酸羟基氧示踪法,写出乙醇羟基氧示踪法的产物为 ____ 和 ____ 。
(4)已知醋酸羟基氧示踪法中,产物含氧18水占到总水量的一半,酯也一样。该实验说明酯化反应 ____ (填“是”或“不是”)简单的取代反应。
(5)在投料1:1的情况下,测得120℃时,CH3COOH平衡转化率为65%,该温度下反应的平衡常数K= ____ 。(保留三位有效数字)
Ⅲ.乙酸乙酯的催化水解(酯化反应的逆反应)探究。
已知:①乙酸乙酯的沸点约77℃;
②酸和碱均可用作酯水解的催化剂。
实验步骤:向试管中加入8molNaOH溶液,再加入2mL乙酸乙酯,量出乙酸乙酯的高度。再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行。改变NaOH溶液的浓度,重复实验。乙酸乙酯水解后剩余高度/mm数据如表所示:
| 组别 | c(NaOH)/mol•L-1 | 时间/min | ||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 | 6.5 |
| 2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 | 4.5 |
| 3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 | 1.5 |
(6)分析上述数据,得到乙酸乙酯水解速率的规律是:
①NaOH溶液浓度越大,水解速率越 ____ ;
② ____ 。
(7)结论②的理论解释是 ____ 。
(8)该实验必须严格控制NaOH溶液的体积、乙酸乙酯的用量和反应的温度。为了达到实验的目的,有同学建议用 ____ 代替NaOH溶液重复试验,对数据进行修正。
题目解答
答案
解:(1)因为乙酸和乙醇易溶于碳酸钠溶液,可能发生倒吸,则装置中球形干燥管,除起到导气冷凝作用外,另一重要作用防止倒吸,
故答案为:防止倒吸;
(2)乙酸乙酯中混有乙酸和乙醇,乙醇易溶于水,乙酸可以和碳酸钠反应,因此用饱和Na2CO3溶液除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,
故答案为:饱和Na2CO3溶液;
(3)乙酸和乙醇在浓硫酸催化作用下发生酯化反应,酯化反应的实质是酸去羟基醇去氢,反应的化学方程式为CH3COOH+H18OCH2CH3$⇌_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,
故答案为:CH3CO18OCH2CH3;H2O;
(4)用醋酸羟基氧示踪含氧18水占到总水量的一半,酯也一样,说明酯化反应的历程可能是首先乙酸分子中含有碳氧双键打开发生加成反应,氧上连氢原子,碳上连乙氧基,生成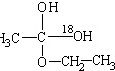 ,连在同一碳上的两个羟基不稳定,会脱水,脱水有两种情况,可能分别生成
,连在同一碳上的两个羟基不稳定,会脱水,脱水有两种情况,可能分别生成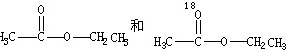 ,该实验说明酯化反应不是简单的取代反应,
,该实验说明酯化反应不是简单的取代反应,
故答案为:不是;
(5)在投料1:1的情况,设反应物起始浓度为a mol/L
CH3COOH+H18OCH2CH$⇌_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
反应起始(mol/L):a a 0 0
反应转化(mol/L):0.65a 0.65a 0.65a 0.65a
反应平衡(mol/L):0.35a 0.35a 0.65a 0.65a
K=$\frac{c(乙酸乙酯)c({H}_{2}O)}{c(乙醇)c(乙酸)}$=$\frac{0.65a×0.65a}{0.35a×0.35a}$=3.45,
故答案为:3.45;
(6)由表格可知,NaOH溶液浓度越大,水解速率越快,氢氧化钠浓度相同时,乙酸乙酯水解速率先快后慢,一段时间后停止水解,
故答案为:①快;②乙酸乙酯水解速率先快后慢,一段时间后停止水解,
(7)NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用,
故答案为:NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用;
(8)为使得实验结果更加精确,应用蒸馏水作为对照组代替NaOH溶液重复试验,排除干扰,
故答案为:蒸馏水。
故答案为:防止倒吸;
(2)乙酸乙酯中混有乙酸和乙醇,乙醇易溶于水,乙酸可以和碳酸钠反应,因此用饱和Na2CO3溶液除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,
故答案为:饱和Na2CO3溶液;
(3)乙酸和乙醇在浓硫酸催化作用下发生酯化反应,酯化反应的实质是酸去羟基醇去氢,反应的化学方程式为CH3COOH+H18OCH2CH3$⇌_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,
故答案为:CH3CO18OCH2CH3;H2O;
(4)用醋酸羟基氧示踪含氧18水占到总水量的一半,酯也一样,说明酯化反应的历程可能是首先乙酸分子中含有碳氧双键打开发生加成反应,氧上连氢原子,碳上连乙氧基,生成
 ,连在同一碳上的两个羟基不稳定,会脱水,脱水有两种情况,可能分别生成
,连在同一碳上的两个羟基不稳定,会脱水,脱水有两种情况,可能分别生成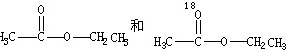 ,该实验说明酯化反应不是简单的取代反应,
,该实验说明酯化反应不是简单的取代反应,故答案为:不是;
(5)在投料1:1的情况,设反应物起始浓度为a mol/L
CH3COOH+H18OCH2CH$⇌_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
反应起始(mol/L):a a 0 0
反应转化(mol/L):0.65a 0.65a 0.65a 0.65a
反应平衡(mol/L):0.35a 0.35a 0.65a 0.65a
K=$\frac{c(乙酸乙酯)c({H}_{2}O)}{c(乙醇)c(乙酸)}$=$\frac{0.65a×0.65a}{0.35a×0.35a}$=3.45,
故答案为:3.45;
(6)由表格可知,NaOH溶液浓度越大,水解速率越快,氢氧化钠浓度相同时,乙酸乙酯水解速率先快后慢,一段时间后停止水解,
故答案为:①快;②乙酸乙酯水解速率先快后慢,一段时间后停止水解,
(7)NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用,
故答案为:NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用;
(8)为使得实验结果更加精确,应用蒸馏水作为对照组代替NaOH溶液重复试验,排除干扰,
故答案为:蒸馏水。