题目
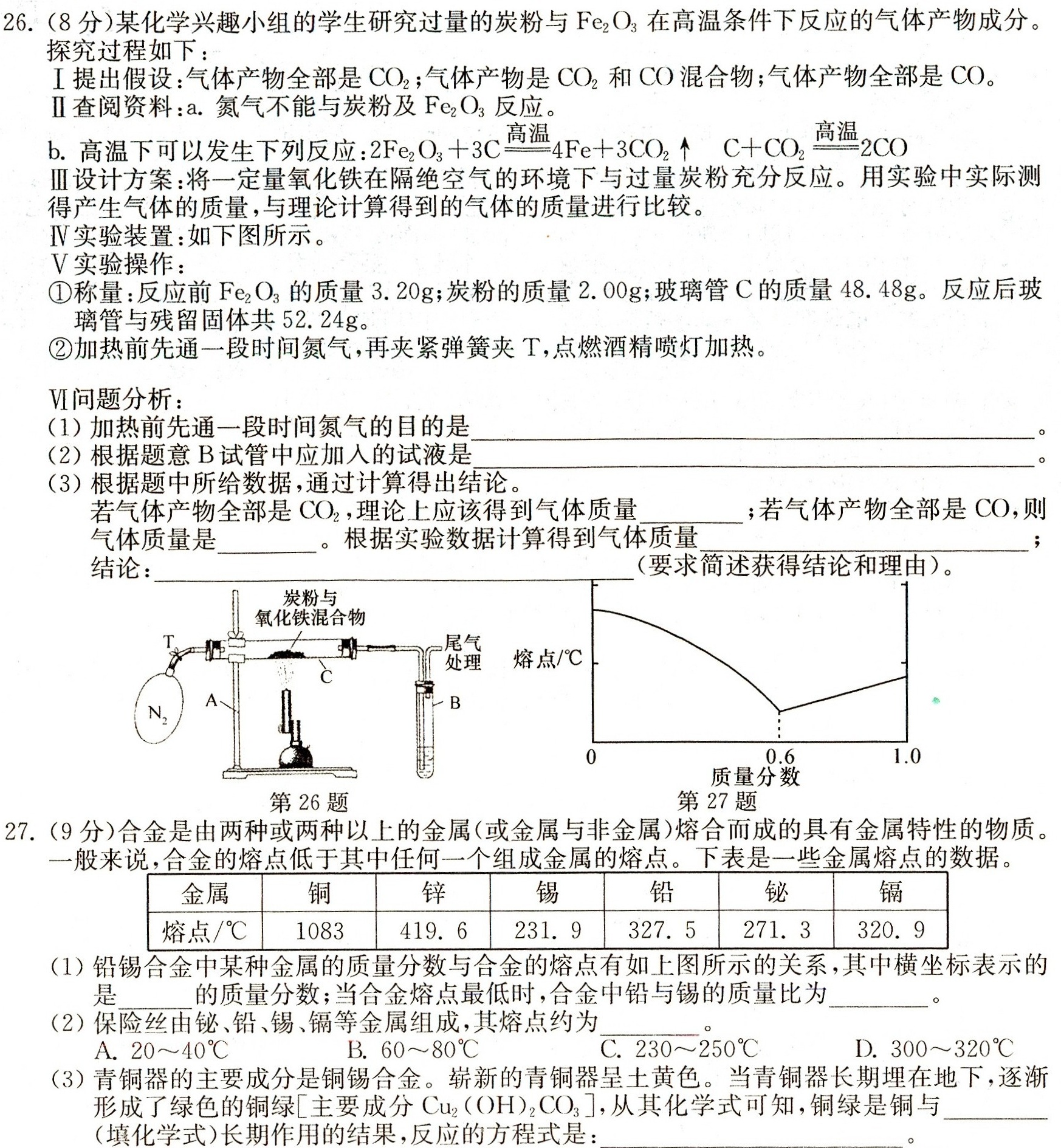
26.(8分)某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分。-|||-探究过程如下:-|||-提出假设:气体产物全部是CO2;气体产物是CO2和CO混合物;气体产物全部是CO。-|||-查阅资料:a.氮气不能与炭粉及Fe2O3反应。-|||-b.高温下可以发生下列反应: (Fe)_(2)(O)_(3)+3Cxlongequal (高温)4Fe+3C(O)_(2)uparrow +C(O)_(2)xlongequal (高温)2CO-|||-设计方案:将一定量氧化铁在隔绝空气的环境下与过量炭粉充分反应。用实验中实际测-|||-得产生气体的质量,与理论计算得到的气体的质量进行比较。-|||-实验装置:如下图所示。-|||-实验操作:-|||-①称量:反应前Fe2O3的质量3.20g;炭粉的质量2.00g;玻璃管C的质量48.48g。反应后玻-|||-璃管与残留固体共52.24g。-|||-②加热前先通一段时间氮气,再夹紧弹簧夹T,点燃酒精喷灯加热。-|||-VI问题分析:-|||-(1)加热前先通一段时间氮气的目的是 o-|||-(2)根据题意B试管中应加入的试液是 o-|||-(3)根据题中所给数据,通过计算得出结论。-|||-气体产物全部是CO2,理论上应该得到气体质量 __ 若气体产物全部是CO,则-|||-气体质量是 __ 根据实验数据计算得到气体质量 __ ;-|||-结论: __ 要求简述获得结论和理由)。-|||-炭粉与-|||-氧化铁混合物-|||-T 尾气-|||-处理-|||-N2 B-|||-A-|||-第26题-|||-熔点/℃-|||-0 0.6 1.0-|||-质量分数-|||-27题-|||-27.(9分)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。-|||-般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。-|||-金属 铜 锌 锡 铅 铋 镉-|||-熔点/℃ 1083 419.6 231.9 327.5 271.3 320.9-|||-(1)铅锡合金中某种金属的质量分数与合金的熔点有如上图所示的关系,其中横坐标表示的-|||-是 __ 的质量分数;当合金熔点最低时,合金中铅与锡的质量比为 __ 。-|||-(2)保险丝由铋、铅、锡、镉等金属组成,其熔点约为 __-|||-A. ^circ approx (40)^circ C B. backsim (80)^circ C C. ^circ approx (250)^circ C D. backsim (320)^circ C-|||-(3)青铜器的主要成分是铜锡合金。崭新的青铜器呈土黄色。当青铜器长期埋在地下,逐渐-|||-形成了绿色的铜绿[主要成分Cu2(OH)2CO3],从其化学式可知,铜绿是铜与 __-|||-填化学式)长期作用的结果,反应的方程式是: __
题目解答
答案
