题目
28.Mg(OH)2在下列哪种溶液中具有最大的溶解度-|||-A. .1molcdot (L)^-1HCl B.纯水 C. .1molcdot (L)^-1N(H)_(3)cdot (H)_(2)O-|||-D. .1molcdot (L)^-1Mg(Cl)_(2) E.无法确定

题目解答
答案
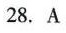
解析
步骤 1:理解溶解度和溶度积常数
Mg(OH)2的溶解度受其溶度积常数(Ksp)的影响。Ksp是溶解平衡状态下,Mg2+和OH-离子浓度的乘积。Mg(OH)2的溶解度会受到溶液中OH-和Mg2+浓度的影响。
步骤 2:分析各选项对Mg(OH)2溶解度的影响
A. $0.1mol\cdot {L}^{-1}HCl$:HCl会提供H+离子,与OH-反应生成水,降低OH-浓度,从而促进Mg(OH)2的溶解。
B. 纯水:纯水中Mg(OH)2的溶解度由其自身的Ksp决定。
C. $0.1mol\cdot {L}^{-1}N{H}_{3}\cdot {H}_{2}O$:NH3·H2O会提供OH-离子,增加OH-浓度,抑制Mg(OH)2的溶解。
D. $0.1mol\cdot {L}^{-1}Mg{Cl}_{2}$:MgCl2会提供Mg2+离子,增加Mg2+浓度,抑制Mg(OH)2的溶解。
步骤 3:确定最大溶解度的溶液
根据上述分析,$0.1mol\cdot {L}^{-1}HCl$会降低OH-浓度,从而促进Mg(OH)2的溶解,因此Mg(OH)2在$0.1mol\cdot {L}^{-1}HCl$中具有最大的溶解度。
Mg(OH)2的溶解度受其溶度积常数(Ksp)的影响。Ksp是溶解平衡状态下,Mg2+和OH-离子浓度的乘积。Mg(OH)2的溶解度会受到溶液中OH-和Mg2+浓度的影响。
步骤 2:分析各选项对Mg(OH)2溶解度的影响
A. $0.1mol\cdot {L}^{-1}HCl$:HCl会提供H+离子,与OH-反应生成水,降低OH-浓度,从而促进Mg(OH)2的溶解。
B. 纯水:纯水中Mg(OH)2的溶解度由其自身的Ksp决定。
C. $0.1mol\cdot {L}^{-1}N{H}_{3}\cdot {H}_{2}O$:NH3·H2O会提供OH-离子,增加OH-浓度,抑制Mg(OH)2的溶解。
D. $0.1mol\cdot {L}^{-1}Mg{Cl}_{2}$:MgCl2会提供Mg2+离子,增加Mg2+浓度,抑制Mg(OH)2的溶解。
步骤 3:确定最大溶解度的溶液
根据上述分析,$0.1mol\cdot {L}^{-1}HCl$会降低OH-浓度,从而促进Mg(OH)2的溶解,因此Mg(OH)2在$0.1mol\cdot {L}^{-1}HCl$中具有最大的溶解度。